
题目列表(包括答案和解析)
22.现有a mol由H2和Cl2组成的混合气体,使之在适宜条件下充分反应后,用足量的NaOH
溶液吸收反应后残余气体,消耗b mol NaOH。试解答下列问题:
(1)通过计算,将计算结果填入下表:
|
|
H2和Cl2物质的量的关系 |
生成NaCl的物质的量 |
|
① |
n(H2)=n(Cl2) |
|
|
② |
n(H2)>n(Cl2) |
|
(2)推断当n(H2)<n(Cl2)时,生成NaCl的物质的量________。
解析:(1)当n(H2)=n(Cl2)和n(H2)>n(Cl2)时,仅发生反应H2+Cl2===2HCl和HCl+
NaOH===NaCl+H2O,且Cl2完全反应,据Cl2的多少计算,n(H2)=n(Cl2)时得NaCl a
mol(或b mol),n(H2)>n(Cl2)时得NaCl b mol。
(2)设H2的物质的量为x mol,则n(Cl2)=(a-x) mol。
H2+Cl2===2HCl
x mol x mol 2x mol
HCl+NaOH===NaCl+H2O
2x mol 2x mol
Cl2(余)+2NaOH===NaCl+NaClO+H2O
(a-x) mol-x mol (a-2x) mol
共生成NaCl:2x mol+(a-2x) mol=a mol
答案:(1)
|
|
H2和Cl2物质的量的关系 |
生成NaCl的物质的量 |
|
① |
n(H2)=n(Cl2) |
a
mol或b
mol |
|
② |
n(H2)>n(Cl2) |
b
mol |
(2)a mol
21.中学化学学习过的一些气体可以用下图装置分别制取、干燥和收集,烧杯中的NaOH溶液用于吸收尾气。根据要求回答以下问题。
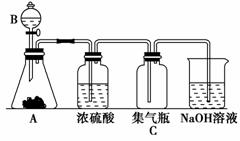
(1)请分析能用该装置制取、干燥、收集和吸收的气体对反应物、反应条件及气体性质必
须符合的要求:
①对反应物的要求:
________________________________________________________________________;
②对反应条件的要求:
________________________________________________________________________;
③对生成气体性质的要求:
________________________________________________________________________。
(2)用该装置制取氯气时,A中是高锰酸钾,B中是浓盐酸,反应后溶液中存在大量Mn2+。分别写出A中和NaOH溶液中发生反应的离子方程式:A中________________,NaOH溶液中________________。
解析:(1)图中气体发生装置属于“固(液)+液气”型,即要求反应物的状态为固
态和液态,并要求反应条件不加热。图给装置中采用浓硫酸干燥生成的气体,要求生
成的气体无还原性和碱性;采用向上排空气法收集生成的气体,要求生成的气体密度
比空气大,且不与空气发生反应;采用NaOH溶液处理尾气,要求生成的气体能被
NaOH溶液吸收。(2)A中和NaOH溶液中反应的化学方程式分别为2KMnO4+
16HCl===2MnCl2+2KCl+5Cl2↑+8H2O、Cl2+2NaOH===NaCl+NaClO+H2O,
改写为离子方程式2MnO-4+16H++10Cl-===2Mn2++5Cl2↑+8H2O、Cl2+
2OH-===Cl-+ClO-+H2O。
答案:(1)①固体或液体与液体反应 ②不需要加热 ③生成的气体能被浓硫酸干燥(不
具有还原性和碱性)、密度比空气大、能(且需要)用氢氧化钠溶液吸收 (2)2MnO-4+
16H++10Cl-===2Mn2++5Cl2↑+8H2O Cl2+2OH-===ClO-+Cl-+H2O
20. 工业上制备单质碘的方法之一是从碘酸盐开始的。第一步先用适量的亚硫酸氢盐将碘
工业上制备单质碘的方法之一是从碘酸盐开始的。第一步先用适量的亚硫酸氢盐将碘
酸盐还原成碘化物,离子方程式为:IO-3+3HSO-3===I-+3SO +3H+。第二步
将第一步得到的酸性碘化物溶液再跟适量的碘酸盐溶液混合,发生反应析出碘。试问:
(1)若要使碘酸盐的利用率最高,碘酸盐在第一步和第二步反应中的用量之比为
________________________________________________________________________。
(2)根据GB5461--《国家食用盐标准》,碘元素含量为20-50 mg/kg 为合格。为检
测某品牌加碘盐是否合格,进行了如下实验:称取250 g某品牌加碘盐样品,在酸性条
件下用足量KI溶液将其中IO-3全部转化成I2,生成的I2再用0.010 mol/L的硫代硫酸
钠溶液滴定(反应方程式为I2+2S2O2-3===2I-+S4O2-6),滴定到终点时用去12.0 mL硫
代硫酸钠溶液,试通过计算说明该加碘食盐是否为合格产品(写出具体的计算过程)。
解析:(1)由题意可知第二步的反应物为I-、H+、IO-3,生成物有I2、H2O,离子方程
式为IO-3+5I-+6H+===3I2+3H2O。要使碘酸盐利用率最高,需将碘元素全部转化为
 I2,由题给信息及(1)中反应知,碘酸盐在第一步和第二步反应中用量之比为5∶1。
I2,由题给信息及(1)中反应知,碘酸盐在第一步和第二步反应中用量之比为5∶1。
(2)由反应转化关系可建立关系式:IO-3-3I2-6S2O ,则:
n(I)=n(IO-3)=1/6×0.010 mol/L×12.0 mL×10-3 L/mL=2×10-5 mol,
m(I)=2×10-5×127×103/(250×10-3)=10.16 mg/kg,小于20 mg/kg,即为不合格
产品。
答案:(1)5∶1 (2)否 计算过程见解析
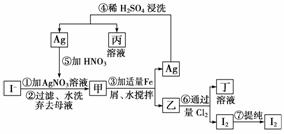
19.在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单
质碘:
试回答:
(1)乙、丁中溶质的分子式:乙________,
丁__________。
(2)第④步操作中用稀硫酸浸洗的目的是__________(填字母编号)。
A.除去未反应的NO-3 B.除去未反应的I-
C.除去未反应的Fe D.除去碱性物质
(3)第⑦步操作可供提纯I2的两种方法是____________和__________(不要求写具体步
骤)。
(4)实验室检验I2的方法是
________________________________________________________________________。
(5)甲物质见光易变黑,反应的化学方程式为
_______________________________________________________________________
_________________________________________________________________。
解析:据框图可知甲为AgI,见光易分解:2AgI2Ag+I2;AgI与铁屑、水搅拌,
会缓慢反应置换出Ag,同时生成乙(FeI2),过滤所得Ag中会混有未反应的Fe,可用
稀H2SO4浸洗除去;FeI2溶液中通稍过量的Cl2时,发生反应:2FeI2+3Cl2===2FeCl3+2I2,提纯I2可利用其易升华的特性,采用加热的方法,也可利用其易溶于有机溶剂,
采用萃取的方法。
答案:(1)FeI2 FeCl3 (2)C (3)加热升华 萃取 (4)将I2加到淀粉溶液中,溶液呈
蓝色 (5)2AgI2Ag+I2
18.用化学方法测定微量碘化物时,必须利用“化学放大”反应将碘的量“放大”,然后再
进行测定。下面是“化学放大”反应的实验步骤:
①向含微量I-并且呈中性或弱酸性溶液里加入溴水,将I-完全氧化成IO-3,煮沸去
掉过量的Br2;②向由①制得的水溶液中加入过量的酸性KI溶液,振荡使反应进行完全;
③在②得到的水溶液中加入足量的CCl4,振荡,把生成的I2从水溶液里全部转移到CCl4
中,用分液漏斗分液去掉水层;④向③得到的CCl4层加入肼(即联氨H2N-NH2)的水溶
液,振荡,使I2完全以I-形式从CCl4层进入水层,用分液漏斗分液去掉CCl4层。
经过以上四步得到的水溶液里,含有通过反应而“放大”了的碘,请回答下列问题:
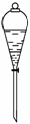
(1)写出步骤②的离子方程式:
________________________________________________________________________。
(2)将右图所示的分液漏斗中的下层液体放出的操作步骤为:
①________________________________________________________________________。
②旋开活塞,使下层液体流出到一个小烧杯里,当下层液体全部流出活塞的细孔时,
________________________________________________________________________。
③从漏斗上口倒出上层液体。
④旋开活塞,将留在颈部的下层液体放出到盛接下层液体的烧杯里。
(3)若忽略实验过程中出现的损失,经过一次“化学放大”的溶液里,I-的量是原溶液里
I-的量的 倍。经过n次“化学放大”的溶液里,I-的量是原溶液里的量的
倍。
解析:考查氧化还原和萃取分液的实验操作。
5I-+IO-3+6H+===3I2+3H2O,经过该反应得到的I2又和H2N-NH2发生氧化还原反应生
成I-,这样得到的I-是原来的6倍,所以经过n次“化学放大”的溶液里,I-的量是原
溶液里的量的6n倍。
答案:(1)5I-+IO-3+6H+===3I2+3H2O (2)①取下漏斗口上的塞子[或使塞子上的凹槽(或
小孔)对准漏斗上的小孔] ②迅速关闭活塞 (3)6 6n
16.2009年夏天,因连日下雨,雨水漏进台北市区一间存放消毒用漂白粉的屋子,屋内物质之间发生化学反应,冒出浓烟。据了解,由于风向比较复杂,整个营地的两千多人被紧急疏散。在排险过程中,有61名官兵因氯气中毒,被紧急送往医院救治。下列说法正确的是 ( )
A.人群应该向着低洼处紧急疏散
B.可能是漂白粉内的物质在一定条件下发生氧化还原反应而散发出氯气
C.紧急疏散人群的同时,应向散发氯气的地方喷洒氢氧化钠浓溶液
D.漂白粉若长时间放置在露天仓库中变质,其中只发生了一个化学反应
解析:漂白粉的主要成分为CaCl2、Ca(ClO)2,在酸性环境中,Cl-、ClO-发生氧化
还原反应而产生氯气:Cl-+ClO-+2H+===Cl2↑+H2O。
答案:B
15.已知NaCN溶液呈碱性;(CN)2与卤素单质的性质相似;CN-的还原性介于Br-、I-之
间。下列反应不能发生的是 ( )
 A.HCN-
H++CN-
A.HCN-
H++CN-
B.(CN)2+CH2CH2―→NC-CH2-CH2-CN
C.(CN)2+2Br-===2CN-+Br2
D.(CN)2+2OH-===CN-+CNO-+H2O
解析:由信息知:(CN)2与卤素单质的性质相似,由卤素单质的性质类比可知B、D正
确;NaCN溶液呈碱性,可知HCN是弱酸,故A正确。
答案:C
14.通过置换反应不可能生成 ( )
A.Fe3O4 B.F2 C.Al2O3 D.C
解析:F2是氧化性最强的单质,没有哪种单质能从其氟化物中置换出来,对A,反应
为3Fe+4H2O(g)Fe3O4+4H2;对C,反应为2Al+Fe2O3Al2O3+2Fe;对D,
反应为2Mg+CO22MgO+C。
答案:B
13.向100 mL FeCl2溶液中滴入含Br2 0.05 mol的溴水,测得加入的溴已完全反应,形成的溶液不含Fe2+,则原FeCl2溶液的物质的量浓度为 ( )
A.0.5 mol·L-1 B.1 mol·L-1 C.1.5 mol·L-1 D.2 mol·L-1
解析:由关系式2Fe2+-Br2知c(FeCl2)×100×10-3 mol∶0.05 mol=2∶1,即c(FeCl2)=1 mol·L-1。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com