
题目列表(包括答案和解析)
9.解释某些化学现象时要考虑盐的水解。如用FeCl3溶液制备氢氧化铁胶体、用明矾、FeCl3作净水剂,都与盐的水解有关:Fe3+ + 3H2O  Fe(OH)3(胶体)+3H+、Al3++3H2O
Fe(OH)3(胶体)+3H+、Al3++3H2O  Al(OH)3 (胶体) +
3H+ ,胶体可以吸附不溶性杂质一同沉到水底。用Na2FeO4、氯气和绿矾混合作消毒、杀菌、净化剂也与盐的水解有关:+6价的铁具有强氧化性(可杀菌),其还原产物水解生成Fe(OH)3 胶体具有吸附性。
Al(OH)3 (胶体) +
3H+ ,胶体可以吸附不溶性杂质一同沉到水底。用Na2FeO4、氯气和绿矾混合作消毒、杀菌、净化剂也与盐的水解有关:+6价的铁具有强氧化性(可杀菌),其还原产物水解生成Fe(OH)3 胶体具有吸附性。
8.某些盐的分离除杂要考虑盐的水解。例如,为了除去氯化镁酸性溶液中的Fe3+离子, 可在搅拌加热的条件下加入一种试剂,过滤后再加入适量盐酸,这种试剂是
A.MgO B.NaOH C.浓氨水 D.MgCO3固体
解析:除杂的基本原则是不引入新的杂质,故B、C选项剔除。 Fe3+在溶液中存在水解平衡,加入MgO 或MgCO3发生如下反应:MgO+2H+==Mg2++H2O,
MgCO3+2H+==Mg2++H2O+CO2↑,使c(H+)降低,促使水解平衡向右移动,即除去了Fe3+,又不引入新的杂质。故答案为A、D。
7.某些试剂的实验室贮存要考虑盐的水解。如贮存Na2CO3溶液不能用玻璃塞,因为Na2CO3溶液水解后碱性较强,这样SiO2+2 OH-==SiO32-+H2O,Na2SiO3具有粘性,使瓶颈与瓶塞粘结在一起;NH4F溶液不能用玻璃瓶盛装,因为水解时产生的的氢氟酸腐蚀玻璃,
F-+H2O 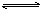 HF+OH-,4HF+SiO2===SiF4↑+2H2O;
HF+OH-,4HF+SiO2===SiF4↑+2H2O;
6、施用化肥时需要考虑到水解。如草木灰(含K2CO3)不能与铵态氮肥相混用。因为CO32-+H2O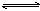 HCO3-+OH-,NH4++ OH-
HCO3-+OH-,NH4++ OH- 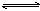 NH3·H2O
NH3·H2O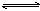 NH3+H2O,随NH3挥发,氮肥肥效降低;过磷酸钙不宜与草木灰混合施用,同样是因草木灰中的K2CO3水解显碱性,使可溶的磷酸二氢钙[Ca(H2PO4)2]转化为难溶的Ca3(2PO4)2,不易被植物吸收。
NH3+H2O,随NH3挥发,氮肥肥效降低;过磷酸钙不宜与草木灰混合施用,同样是因草木灰中的K2CO3水解显碱性,使可溶的磷酸二氢钙[Ca(H2PO4)2]转化为难溶的Ca3(2PO4)2,不易被植物吸收。
5、选择制备盐的途径时需考虑盐的水解。有些盐(如Al2S3)遇水即水解,无法在溶液中制取,只能由单质直接反应制取(干法制取);还有些盐(如FeCl3 、AlCl3 )必须在蒸发过程中不断通入HCl气体,以抑制阳离子的水解,才能得到其固体。
4、判断盐溶液中有关离子能否大量共存时,要考虑盐的水解(主要是双水解问题)。如水解显酸性的Al3+、Fe3+与水解显碱性的HCO3-、CO32-等都不能都不能大量共存。
3、配制某些易水解的盐溶液时,需考虑盐的水解。如配制Al2(SO4)3溶液时需加少量的H2SO4,配制FeCl3溶液时需加少量的HCl抑制盐中阳离子的水解(加组成盐相应的强酸或强碱);
2、比较盐溶液中离子浓度的大小或离子数目的多少,要考虑盐的水解。如Na2CO3溶液中,因存在:CO32-+H2O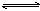 HCO3-+OH- ,所以有c(Na+)﹥2c(CO32-);
HCO3-+OH- ,所以有c(Na+)﹥2c(CO32-);
1、判断盐溶液的酸碱性或判断某些盐溶液能否使某种指示剂变色时,要考虑盐的水解。如NH4Cl溶液呈酸性,原因是:NH4++H2O 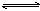 NH3·H2O+ H+;Al2(SO4)3溶液能使石蕊试液显红色,原因是存在水解平衡: Al3+
+ 3H2O
NH3·H2O+ H+;Al2(SO4)3溶液能使石蕊试液显红色,原因是存在水解平衡: Al3+
+ 3H2O 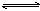 Al(OH)3 + 3H+,使溶液显酸性。
Al(OH)3 + 3H+,使溶液显酸性。
18.水的电离平衡曲线如图所示:
(1)若以A点表示25℃时水的电离平衡时的离子
浓度,当温度升高到100℃时,水的电离平衡
状态到B点,则此时水的离子积从
增加到 。
(2)将pH= 8的Ba(OH)2溶液与pH=5的稀盐酸混合,
并保持100℃的恒温,致使混合溶液的pH=7,
则Ba(OH)2溶液与盐酸的体积比为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com