
题目列表(包括答案和解析)
0.05 mL),则①和②的c(H+)之比的值为( )
A.10 B.50 C.5×103 D.104
解析:当多加1滴硫酸时,过量的H+为:0.05 mL××2×0.01 mol·L-1=1×10-6 mol,
c(H+)1==10-5 mol·L-1,当少加1滴H2SO4时,即NaOH过量1×10-6 mol,c(OH-)==10-5 mol·L-1。则c(H+)2==10-9 mol·L-1,
∴==104。
答案:D
4.用0.01 mol·L-1 H2SO4溶液滴定0.01 mol·L-1 NaOH溶液,中和后加水至100 mL。若滴定时终点判断有误差:①若多加了1滴H2SO4 ②若少加了1滴H2SO4溶液(设1滴约为
3. 用0.1 mol·L-1NaOH溶液滴定0.1 mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是( )
A.4 B.7.2 C.10 D.11.3
解析:运用化学反应进行中和反应计算
c(OH-)==1×10-4 mol·L-1,pH=10。
答案:C
2. 将固体MnC2O4·2H2O放在一个可以称出质量的容器里加热,固体质量随温度变化关系如图所示。纵坐标是固体的相对质量。下列关于5个温度区间存在的物质及其稳定性或物质发生的变化(用化学方程式表示)的说法不正确的是( )
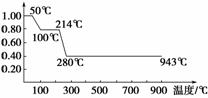
A.0-50℃为MnC2O4·2H2O的稳定区域
B.在50-100℃,发生反应为:MnC2O4·2H2O===MnC2O4+2H2O(g)
C.在100-214℃,固体的质量不变,所以为MnC2O4的稳定区域
D.在214-280℃,发生的反应为:MnC2O4===MnO2+2CO↑
解析:从图像中可知:①平行于横坐标的线段,表示容器内固体物质的质量在此温度范围内不随时间而变化,属固体的稳定区域;②向下倾斜的线段,表示某固体物质的质量在此温度范围内逐渐减少,减少的原因是该固体发生了某种分解反应。分解反应生成什么物质,氧化反应生成何种价态的氧化物,应先根据物质的性质进行猜测,再根据固定物质减少的质量或增加的质量进行验证。
0-50℃:为MnC2O4·2H2O的稳定区域,A正确。
50-100℃:猜测:MnC2O4·2H2O===MnC2O4+2H2O(g)
179 143
此时固体的相对质量为143/179≈0.8,符合题意,B正确。
100-214℃:为MnC2O4的稳定区域,C正确。
214-280℃:猜测:MnC2O4===MnO2+2CO↑
143 87
此时固体的相对质量为:87/179≈0.49>0.4,不符合题意。
答案:D
1.下列说法正确的是( )
①pH=2和pH=1的HNO3中c(H+)之比为1∶10
②0.2 mol/L与0.1 mol/L醋酸中,c(H+)之比大于2∶1
③Na2CO3溶液中c(Na+)与c(CO)之比为2∶1
④纯水在100℃和20℃时,pH前者大
⑤同温时,pH=10的KOH溶液和pH=10的KCN溶液中由水电离的OH-浓度后者大
⑥100 mL 0.1 mol/L的醋酸溶液与10 mL 1.0 mol/L的醋酸溶液中H+的数目,前者多
A.①④⑤ B.①⑤⑥ C.①②⑤ D.①②③⑥
解析:0.2 mol/L CH3COOH溶液电离程度比0.1 mol/L CH3COOH溶液电离程度小,c(H+)之比小于2∶1;CO水解,Na2CO3溶液中c(Na+)与c(CO)之比大于2∶1;纯水在100℃时电离程度大,H+浓度大,其pH小于20℃时的pH。
答案:B
9.测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol/L的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式________________________________________________________________________。
(2)判断滴定终点的方法是________________________________________________________________________。
(3)计算:血液中含钙离子的浓度为________g·mL-1。
解析:因为KMnO4溶液至反应完毕过量时,会使溶液呈紫色,故可用滴入一滴酸性KMnO4溶液由无色变为浅紫色且半分钟不退色的方法来判断终点。由题意知可能发生反应的离子方程式为:2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O、Ca2++C2O===CaC2O4↓、CaC2O4+2H+===Ca2++H2C2O4。
设2 mL血液中含Ca2+的物质的量为x,则
5Ca2+-5CaC2O4-5H2C2O4-2MnO
5 2
x 20.0×10-3 L×1.0×10-4 mol/L
x=5.0×10-6 mol,1 mL血液中Ca2+的浓度为
=1.0×10-4 g·mL-1。
答案:(1)2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O (2)当滴入1滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不退色 (3)1.0×10-4

8. 常温下,pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显酸性;0.01 mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显中性。
请回答下列问题:
(1)高碘酸是________(填“强酸”或“弱酸”),理由是________________________________________________________________________。
(2)0.01 mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合所得溶液中IO与Na+的浓度关系是________(填“大于”、“小于”或“等于”)。
(3)已知高碘酸和硫酸锰在溶液中反应生成高锰酸、碘酸和硫酸,此反应中的还原剂是__________(写化学式),该反应的离子方程式为________________________________________________________________________。
解析:pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显酸性,则高碘酸必定是不完全电离,可推知高碘酸是弱酸;同理可推出碘酸(HIO3)和高锰酸为强酸,等物质的量反应后,IO与Na+的浓度相等。
答案:(1)弱酸 pH=2的高碘酸电离出的c(H+)和pH=2的NaOH溶液电离出的c(OH-)相等,且两者体积相等,但所得溶液显酸性,则高碘酸必定是不完全电离,所以高碘酸是弱酸 (2)等于 (3)MnSO4 2Mn2++5HIO4+3H2O===2MnO+5IO+11H+
7. Al(OH)3为两性氢氧化物,在水溶液中存在酸式电离和碱式电离两种形式,试根据平衡移动反应物质,解释下列有关问题。
(1)向Al(OH)3沉淀中加入盐酸,沉淀溶解,其原因是__________________________,有关离子方程式是_____________________________________________________________。
(2)向Al(OH)3沉淀中加入苛性钠溶液,沉淀溶解,其原因是__________________,有关离子方程式是_____________________________________________________________。
解析:难溶电解质溶解的实质是沉淀溶解平衡的移动,在Al(OH)3溶液中,存在如下电离平衡:Al(OH)3+H2O 
 [Al(OH)4]-+H+;Al(OH)3
[Al(OH)4]-+H+;Al(OH)3 
 Al3++3OH-,所以改变溶液的酸碱度时,平衡就会发生移动,使Al(OH)3向着溶解的方向移动,最终转化为离子。
Al3++3OH-,所以改变溶液的酸碱度时,平衡就会发生移动,使Al(OH)3向着溶解的方向移动,最终转化为离子。
答案:(1)Al(OH)3的碱式电离为Al(OH)3 
 Al3++3OH-,加入盐酸溶液,由于H+与Al(OH)3电离出来的少量OH-中和生成水,使Al(OH)3的电离平衡向电离方向移动 Al(OH)3+3H+===Al3++3H2O (2)Al(OH)3的酸式电离为Al(OH)3+H2O
Al3++3OH-,加入盐酸溶液,由于H+与Al(OH)3电离出来的少量OH-中和生成水,使Al(OH)3的电离平衡向电离方向移动 Al(OH)3+3H+===Al3++3H2O (2)Al(OH)3的酸式电离为Al(OH)3+H2O 
 H++[Al(OH)4]-,当向Al(OH)3沉淀中加入碱溶液时,OH-与H+反应生成水,Al(OH)3的酸式电离平衡向正方向移动 Al(OH)3+OH-===[Al(OH)4]-
H++[Al(OH)4]-,当向Al(OH)3沉淀中加入碱溶液时,OH-与H+反应生成水,Al(OH)3的酸式电离平衡向正方向移动 Al(OH)3+OH-===[Al(OH)4]-
6. 下列说法正确的是( )
A.HCl溶液中无OH-
B.NaOH溶液中无H+
C.NaCl溶液中无H+和OH-
D.常温下,任何溶液中都有H+和OH-,且KW=[H+]·[OH-]=1×10-14 mol2·L-2
解析:在任何物质的水溶液中都存在水的电离平衡:H2O 
 H++OH-,因此,在任何物质的水溶液中,既存在H+又存在OH-,且常温下,KW=[H+]·[OH-]=1×10-14
H++OH-,因此,在任何物质的水溶液中,既存在H+又存在OH-,且常温下,KW=[H+]·[OH-]=1×10-14
mol2·L-2。
答案:D
5. 一种一元强碱MOH溶液中加入一种酸HA反应之后,溶液呈中性,下列判断正确的是( )
A.加入的酸过量 B.混合前碱与酸中溶质物质的量相等
C.生成的盐不发生水解 D.反应后溶液中的A-、M+物质的量浓度相等
解析:当HA为强酸时,两者的物质的量相等,恰好完全反应,生成的盐不水解,溶液呈中性;当HA为弱酸时,两者恰好完全反应时,因生成的A-水解使溶液显碱性,欲使溶液显中性,需再加HA来抑制A-水解,则HA过量;溶液呈中性,则c(H+)=c(OH-),根据电荷守恒,c(H+)+c(M+)=c(OH-)+c(A-),所以,c(M+)=c(A-)。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com