
题目列表(包括答案和解析)
9. 在原电池构成的闭合回路中,关于电子和阴、阳离子运动方向的描述正确的是( )
A.电子从原电池的负极通过导线移向正极 B.电子从原电池的正极通过导线移向负极
C.阴离子在电解质溶液中向正极移动 D.阳离子在电解质溶液中向正极移动
解析:根据同一闭合回路中,同性电荷运动方向一致,异性电荷运动方向相反的规律,在电解质溶液中阴离子向负极移动,阳离子向正极移动。
答案:AD
8.用锌粒和盐酸制氢气时,加入少量下列试剂,可使生成氢气的速率加快的是( )
A.硫酸铜晶体 B.水 C.氯化钡晶体 D.醋酸钾晶体
解析:锌与硫酸铜溶液反应生成铜,铜与锌在酸溶液中构成原电池,加速锌失去电子;加水,盐酸浓度降低,反应速率减小,B错;加入氯化钡晶体,无影响,C错;加入醋酸钾,盐酸与其反应生成弱酸醋酸,反应速率减小,D错。
答案:A
7.将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,如图所示,最先观察到变为红色的区域为( )
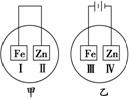
A.Ⅰ和Ⅱ B.Ⅰ和Ⅳ
C.Ⅱ和Ⅲ D.Ⅱ和Ⅳ
解析:甲为原电池装置,Zn为负极,该条件下,Zn被腐蚀,电极反应为负极:
Zn-2e-―→Zn2+,正极:2H2O+O2+4e-―→4OH-,故Ⅰ电极c(OH-)增大使酚酞变红。乙为电解装置,电极反应为:阳极Fe-2e-―→Fe2+,阴极2H++2e-―→H2↑,Ⅳ极区域c(OH)-增大,使酚酞变红。
答案:B
6.(2009·潍坊统考)现将氯化铝溶液蒸干灼烧并熔融后用铂电极进行电解,下列有关电极产物的判断正确的是( )
A.阴极产物是氢气 B.阳极产物是氧气
C.阴极产物是铝和氧气 D.阳极产物只有氯气
解析:本题既考查盐类水解,又考查电解知识,AlCl3+3H2OAl(OH)3+3HCl加热时平衡右移,生成Al(OH)3,加热灼烧得氧化铝,电解氧化铝的阴极产物是铝,阳极产物是氧气。
答案:B
5.相同材质的铁在图中的四种情况下最不易被腐蚀的是( )
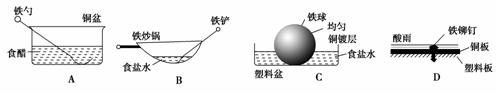
解析:在A中,食醋提供电解质溶液环境,铁勺和铜盆是相互接触的两个金属电极,形成原电池,铁是活泼金属作负极;在B中,食盐水提供电解质溶液环境,炒锅和铁铲都是铁碳合金,符合原电池形成的条件,铁是活泼金属作负极,碳作正极;在D中,酸雨提供电解质溶液环境,铁铆钉和铜板分别作负、正极,形成原电池;在上述三种情况中,都是铁作负极,铁容易被腐蚀;在C中,铜镀层将铁球覆盖、使铁被保护,所以铁不易被腐蚀。
答案:C
4. (2009·广东单科,10)出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是( )
A.锡青铜的熔点比纯铜高
B.在自然环境中,锡青铜中的锡可对铜起保护作用
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中慢
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
解析:A项,合金的熔点低于各成分金属的熔点;B项,活泼金属作负极,活泼金属易腐蚀;D项,电化学腐蚀过程一定是化学反应过程。
答案:B
3. 如图甲是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如图乙所示,则卡片上的描述合理的是( )
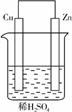
图甲

图乙
A.①②③ B.②④ C.④⑤⑥ D.③④⑤
解析:①中Cu为正极,Zn为负极,③中SO向负极移动,⑤中电子的流向是:Zn→Cu,⑥中正极反应式:2H++2e-―→H2↑,故①③⑤⑥错。
答案:B
2.关于铅蓄电池的说法正确的是( )
A.在放电时,正极发生的反应是Pb(s)+SO(aq)―→PbSO4(s)+2e-
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e-―→Pb(s)+SO(aq)
解析:A项中电池放电时正极应发生还原反应,电极反应为:
PbO2+4H++SO+2e-―→PbSO4+2H2O;C项中电池充电时硫酸的浓度应不断增大;D项中电池充电时阳极应发生氧化反应。
答案:B
1.下列关于金属腐蚀的叙述中,正确的是( )
A.金属被腐蚀的本质是:M-ne-―→Mn+(M表示金属)
B.金属发生电化学腐蚀一定是在酸性环境中
C.镀锌铁发生电化学腐蚀时是锌被腐蚀,而铁一定不会被腐蚀
D.金属发生电化学腐蚀时是较活泼金属作负极,先被腐蚀
解析:金属的电化学腐蚀也可以在中性、碱性环境下进行;镀锌铁中锌若被腐蚀完,Fe也可能继续被腐蚀,而且实际上锌被腐蚀后露出的铁也会被空气、水所腐蚀(即铁的吸氧腐蚀)。
答案:AD
12.(2009·潍坊统考)如图甲、乙是电化学实验装置。

(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为
________________________________________________________________________;
②乙中总反应的离子方程式为
________________________________________________________________________;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后退色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为
________________________________________________________________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为
________________________________________________________________________;
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入________(填写物质的化学式)________g。
解析:(1)甲装置为原电池,乙装置为电解池,当盛有食盐水时,甲中发生吸氧腐蚀,乙中根据电子的流向知,石墨棒为阳极、铁棒为阴极,所以甲中石墨棒上发生的电极反应是2H2O+O2+4e-―→4OH-,而B中电解食盐水的离子方程式为:2Cl-+2H2O2OH-+H2↑+Cl2↑,根据Cl2和I2反应的量及产物知5Cl2+I2+6H2O===2HIO3+10HCl。
(2)甲中铁为负极,Fe-2e-―→Fe2+。
乙中电解CuSO4溶液,电解方程式为2CuSO4+2H2O2Cu+O2↑+2H2SO4。根据pH变化求出c(H+)=0.1 mol·L-1。则生成的H2SO4为0.1 mol·L-1×0.2 L×=0.01 mol,则加入氧化铜的物质的量为0.01 mol质量为0.8 g。如果加入CuCO3,则为1.24 g。
答案:(1)①O2+2H2O+4e-―→4OH- ②2Cl-+2H2O2OH-+H2↑+Cl2↑ ③5Cl2+I2+6H2O===2HIO3+10HCl (2)①Fe-2e-―→Fe2+ ②CuO 0.8或CuCO3 1.24

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com