
题目列表(包括答案和解析)
21.(2008·天津理综,26)W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为________________________________________________________________________。
(2)W与Y可形成化合物W2Y,该化合物的电子式为________________。
(3)X的硝酸盐水溶液显________性,用离子方程式解释原因:________________________。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_________________。
(5)比较Y、Z气态氢化物的稳定性:________>________(用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是________>________>________>________。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式:_____________________________________。
解析:两种金属的最高价氧化物对应的水化物能反应生成盐和水,应为强碱和两性氢氧化物,因此应为NaOH和Al(OH)3,其反应的离子方程式为Al(OH)3+OH-===[Al(OH)4]-。由W2Y及原子序数Y大于钠,又为短周期元素,知W2Y为Na2S。Al(NO3)3为强酸弱碱盐能发生水解反应,水解后溶液显酸性:Al3++3H2OAl(OH)3+3H+。S低价氧化物为SO2,Z只能为Cl,则SO2与Cl2在水中反应生成HCl和H2SO4。Cl的非金属性强于S,因此HCl的稳定性大于H2S。Na+、Al3+、S2-、Cl-的离子半径不在同一个周期中比较,可借助
r(Al3+)<r(Na+)<r(O2-)来判断,可以得出r(S2-)>r(Cl-)>r(Na+)>r(Al3+)。Cl的最高价氧化物为Cl2O7,与水反应的化学方程式为Cl2O7+H2O===2HClO4。
答案:(1)Al(OH)3+OH-===[Al(OH)4]- (2) (3)酸
(3)酸
Al3++3H2O Al(OH)3+3H+ (4)SO2+Cl2+2H2O===H2SO4+2HCl (5)HCl H2S (6)S2- Cl- Na+ Al3+ (7)Cl2O7(1)+H2O(1)===2HClO4(aq);ΔH=-4Q kJ/mol
Al(OH)3+3H+ (4)SO2+Cl2+2H2O===H2SO4+2HCl (5)HCl H2S (6)S2- Cl- Na+ Al3+ (7)Cl2O7(1)+H2O(1)===2HClO4(aq);ΔH=-4Q kJ/mol
20.Ⅰ.下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表。请在下面的虚线框中用实线画出周期表第一至第六周期的轮廓,并画出金属与非金属的分界线。

Ⅱ.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X,Y既不同族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)请写出下列元素的元素符号:X________,Y________,M________。
(2)请写出下列反应的离子方程式:
N单质与NaOH溶液反应:__________________________________________________。
(3)Y与Z相比,非金属性较强的元素是__________,可以证明该结论的实验是(用离子方程式表示)______________________________________________________________________。
解析:根据题意推断X为氧元素,Z为S元素;X在第二周期,Y与Z同周期,Y在第三周期,则M只能为H元素;Y的最高化合价与最低化合价代数和为6,设最高化合价为a,则最低负化合价为a-8,则a+(a-8)=6⇒a=7,则Y为Cl元素;N为第三周期半径最大的非金属元素,则N为Si。
答案:Ⅰ. 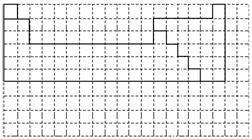
Ⅱ.(1)O Cl H (2)Si+2OH-+H2O===SiO+2H2↑ (3)Cl Cl2+S2-===2Cl-+S↓
19. 在第三周期中,置换氢气能力最强的元素的符号为__________,化学性质最稳定的元素的符号是________,最高价氧化物的水化物酸性最强的酸的化学式是__________,碱性最强的碱的化学式是________,显两性的氢氧化物的化学式是____________,该两性氢氧化物与盐酸、烧碱溶液分别反应的离子方程式为____________________________________、
________________________________________________________________________。
原子半径最小的金属离子结构示意图为_________________________________________。
解析:本题考查同周期元素性质的递变规律。由钠到氯原子半径依次减小,Na+到Al3+,P3-到Cl-半径也分别依次减小。
答案:Na Ar HClO4 NaOH Al(OH)3 Al(OH)3+3H+===Al3++3H2O
Al(OH)3+OH-===[Al(OH)4]- 
18.(2008·上海,23)四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质或 结构 信息 |
室温下单质呈粉末状固体,加热易熔化;单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
单质常温、常压下是气体,能溶于水;原子的M层上有7个电子 |
单质质软、银白色固体、导电性强;单质在空气中燃烧发出黄色的火焰 |
原子最外电子层有4个电子;单质为空间网状晶体,具有很高的熔、沸点 |
(1)B元素在周期表中的位置是______,写出A原子的电子式_______________________。
(2)写出C单质与水反应的化学方程式______________。A与C形成的化合物溶于水后,溶液的pH______7(填“大于”“等于”或“小于”)。
(3)D元素最高价氧化物晶体的硬度______(填“大”或“小”),其理由是________________________________________________________________________。
(4)A、B两元素非金属性较强的是(写元素符号)__________。写出能证明这一结论的一个实验事实________________________________________________________________________。
解析:A元素从“明亮有蓝紫色火焰”,再结合其他信息可知是S元素;B元素从“气体”可知是非金属元素,从M层上有7个“电子”知是Cl元素,与气体易溶于水相吻合。C元素,从“黄色火焰”可知是钠元素,再由前面的信息印证。D元素最外层电子数为4,结合空间网状结构,和“很高的熔、沸点”应该是C元素或Si元素。比较元素非金属性的强弱可从它们之间的相互置换、氢化物的稳定性、最高价氧化物的水化物的酸性强弱等方面去判断。
答案:(1)第三周期ⅦA族 · · (2)2Na+2H2O===2NaOH+H2↑ 大于 (3)大 SiO2是原子晶体(或 小 CO2是分子晶体) (4)Cl 高氯酸的酸性大于硫酸的酸性或氯化氢稳定性比硫化氢强
17.A、B、C为短周期元素,在周期表中所处的位置如下图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。

(1)写出A、B、C三种元素的名称分别为__________、________、________;
(2)B位于元素周期表中第______周期,第____族;
(3)C的原子结构示意图为____________,C的单质与水反应的化学方程式为_____________;
(4)比较B、C的原子半径;B____C,写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式_________________________________________________________。
解析:依题意,A、B、C为短周期元素,从A、B、C的相对位置看,A、C只能处在第二周期,而B处在第三周期。设A的原子序数为x-1,则C为x+1,B为x+8,则有:(x-1)+x+1=x+8 x=8。所以A、B、C的原子序数分别为7、16、9,对应的元素分别为N、S、F。S的原子半径比同主族的O要大,而O比同周期的F要大,因此,S的原子半径大于F的原子半径。
答案:(1)氮 硫 氟 (2)三 ⅥA (3) 2F2+2H2O===4HF+O2 (4)> 2NH3+H2SO4===(NH4)2SO4
16.如何利用实验室常见的药品试剂探究11号-17号元素的金属性逐渐减弱,非金属性逐渐增强?已知实验室有你想用到的仪器和药品、试纸等一切用品。
猜想与假设:(1)用________三种金属分别与水反应,通过观察生成气泡的速率便会得出从______到________金属性逐渐减弱。
(2)因实验室不可能有硅单质,但可以测0.1 mol/L的________溶液和________溶液及Na2SO4溶液的pH,推断三种盐溶液的水解情况,得出________、________、硫酸三种最高价含氧酸的酸性强弱顺序是____________,从而得出从________到________非金属性逐渐增强。
(3)制取饱和的氯水和饱和的氢硫酸溶液,用将________________________方法,通过________现象便直接得出非金属性S比Cl弱。
设计和实施方案:(1)用列表的方式(从实验方案、实验现象、有关化学方程式)完成你的实验报告中的实验内容。
(2)实验结论是______________________________________________________________。
(3)请你用物质结构理论知识解释结论。
解析:[问题]变换一个角度就是实验目的,也应是要得出的结论。根据[猜想与假设]可以设计实验方案,关键细节要注意到,如镁条、铝条都要用砂纸擦后放入沸水中。设计的方案尽量具有可操作性和简单性。
答案:猜想与假设:(1)钠、镁、铝 钠 铝 (2)Na2SiO3 Na3PO4 H2SiO3 H3PO4 H2SiO3<H3PO4<H2SO4 Si S (3)饱和氯水滴加到饱和氢硫酸溶液中的 溶液中有浅黄色沉淀生成
设计和实施方案:
(1)
|
实验方案 |
实验现象 |
有关化学方程式 |
|
用砂纸擦后的镁条、铝条分别投入到盛有沸水的小烧杯中,再分别滴加酚酞 |
投入镁条的试管有大量气泡产生,滴加酚酞后溶液变成浅红色;投入铝条的试管中无明显现象。 |
Mg+2H2OMg(OH)2+H2↑ |
|
将一绿豆粒大小的钠投入到盛有冷水且预先滴有酚酞的小烧杯中 |
钠浮于水面上,迅速熔成闪亮小球四处游动,有响声,随之消失,溶液很快变红色 |
2Na+2H2O===2NaOH+H2↑ |
|
用玻璃棒分别蘸取0.1 mol/L的Na2SiO3(aq)、Na3PO4(aq)、Na2SO4(aq)测其pH |
Na2SiO3(aq)的pH比Na3PO4(aq)的pH大且都大于7;Na2SO4(aq)的pH为7(中性) |
SiO+2H2O H2SiO3+2OH-; H2SiO3+2OH-;PO+H2O  HPO+OH- HPO+OH- |
|
用滴管向盛有5
mL饱和氢硫酸溶液的试管中滴加饱和的氯水 |
试管中有淡黄色沉淀生成 |
Cl2+H2S===2HCl+S↓ |
(2)金属性:Na>Mg>Al 非金属性:Si<P<S<Cl
(3)Na、Mg、Al、Si、S、Cl原子核外都有三个电子层,但最外层电子数依次为1、2、3、4、6、7,原子半径随电子数增多而减小,所以原子核对最外层电子的吸引力依次增强,失电子能力减弱,得电子能力增强。
15.A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,B、C、D同周期,E和其他元素既不在同一周期也不在同一主族,D的氢化物和最高价氧化物对应的水化物均为强酸,且B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)A和D氢化物中,沸点较低的是______(选填“A”或“D”)。
(2)元素C在元素周期表中的位置是______,B的最高价氧化物对应水化物的电子式为________________________________________________________________________。
(3)A、D、E可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2∶2∶1,该盐的名称为____________,它的水溶液与D的氢化物的水溶液反应可生成D的单质,该反应的离子方程式为______________________________________________________。
解析:根据题设条件可推知A为O,B为Na,C为Al,D为Cl,E为Ca。由于H2O分子间存在氢键,其沸点高于HCl。Na的最高价氧化物对应的水化物为NaOH,Na+与OH-以离子键结合,OH-中,O原子与H原子以共价键结合,钙、氯、氧可形成Ca(ClO)2、Ca(ClO3)2、Ca(ClO4)2,其中满足题设条件下的盐为Ca(ClO)2(次氯酸钙)。由于在酸性环境中ClO-具有强氧化性,Cl-具有还原性,二者发生氧化还原反应生成Cl2和H2O∶ClO-+Cl-+2H+===Cl2↑+H2O。
答案:(1)D (2)第三周期ⅢA族 
(3)次氯酸钙 ClO-+2H++Cl-===Cl2↑+H2O
14. 下图为元素周期表前四周期一部分,且X、Y、Z、R和W为主族元素。下列说法中正确的是( )
|
|
X |
|
|
|
Y |
Z |
R |
|
|
|
|
|
W |
A.五种元素一定都是非金属元素
B.五种元素的原子最外层电子数一定都大于2
C.X的氢化物的沸点一定比Z的氢化物的沸点高
D.R的最高价氧化物对应的水化物一定是强酸
解析:Y可能是ⅢA族或ⅣA族元素,当Y位于ⅢA族时,只能是Al元素,故A错,B正确;当Y位于ⅢA族时,X、Z是ⅣA的C、Si,R是ⅤA族的P,CH4的沸点比SiH4的低,H3PO4是中强酸,故C、D均错。
答案:B
13.下列叙述正确的是( )
A.只有非金属元素能形成含氧酸盐
B.所有主族元素的原子,形成单原子离子时的化合价和它的族序数数值相等
C.同一元素的各种同位素的性质相同
D.M层电子数为奇数的所有主族元素所在主族的序数与该元素原子的M层电子数相等
解析:由KMnO4知A叙述错误;由S2-、Cl-知B叙述错误;同一元素的各同位素化学性质几乎完全相同,所形成的物质的物理性质不相同,C叙述错误;D叙述正确。
答案:D
12. 根据元素周期表的结构,试判断同主族两种元素原子的核外电子数的差值可能为( )
A.6 B.12 C.26 D.30
解析:因周期表中1-6周期所含元素种数为2、8、8、18、18、32,第7周期未排满,因此,同一主族相邻元素核外电子数(或原子序数)可能相差2、8、18或32,而题目中未说两种元素一定相邻,那么它们相差的电子数,只有C有可能。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com