
题目列表(包括答案和解析)
6.pH=4的醋酸和氯化铵溶液中,水的电离程度的关系前者与后者比较
A.大于 B.小于 C.等于 D.无法确定
5.25℃时,pH=12的NaOH溶液中,由水电离出的H+离子浓度是
A.1×10-7mol/L B.1×10-12mol/L C.1×10-2mol/L D.1×10-14mol/L
4.25℃时,pH=2的HCl溶液中,由水电离出的H+离子浓度是
A.1×10-7mol/L B.1×10-12mol/L C.1×10-2mol/L D.1×10-14mol/L
3.在纯水中,pH、[H+]、[OH-]的关系肯定不正确的是
A.[H+] ﹥[OH-] B.[H+]﹥10-7 C.PH=6 D.PH﹥7
2.250C时,水的离子积常数为1ⅹ10-14,则该温度下的电离度为
A.1.0ⅹ10-7 % B.1.8ⅹ10-8 % C.1.8ⅹ10-7 % D.1.0ⅹ10-14 %
1.90℃水的离子积KW=3.8×10-13,该温度时纯水的pH
A. 等于7 B. 介于6-7之间 C. 大于7 D. 无法确定
12.(2010天津卷)下列各表述与示意图一致的是
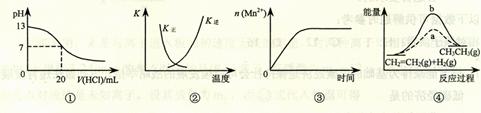
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)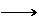 CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化12.把煤作为燃料可以通过下列两种途径:
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化12.把煤作为燃料可以通过下列两种途径:
途径I: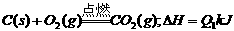
途径II:先制水煤气:
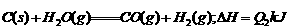
再燃烧水煤气:
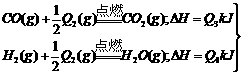
试回答下列问题:
(1)判断两种途径放热:途径I放出的热量_______(填“大于”、“等于”、“小于”)途径II放出的热量。
(2) 、Q4的数学关系式是___________________。
、Q4的数学关系式是___________________。
(3)由于制取水煤气反应里,反应物所具有的总能量______________生成物所具有的总能量,那么在化学反应时,反应物应需要_________能量才能转化为生成物,因此其反应条件为______________。
(4)简述煤通过途径II作为燃料的意义。
______________________________________________________________________________________。
答案:(1)等于
(2)Q1=Q2+Q3+Q4
(3)低于;吸收;高温
(4)固体煤经处理变为气体燃料后,不仅在燃烧时可以大大减少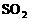 和烟尘对大气造成的污染,而且燃烧效率高,也便于输送
和烟尘对大气造成的污染,而且燃烧效率高,也便于输送
11.已知(1)H2(g) + 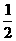 O2(g) = H2O (g) △H1= a kJ·mol-1
O2(g) = H2O (g) △H1= a kJ·mol-1
(2)2H2(g) + O2(g) = 2 H2O (g) △H2= b kJ·mol-1
(3)H2(g) + 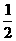 O2(g) = H2O (g) △H3= c kJ·mol-1
O2(g) = H2O (g) △H3= c kJ·mol-1
(4)2H2(g) + O2(g) = 2H2O (g) △H4= d kJ·mol-1
下列关系式正确的是( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
10.已知两个热化学方程式: C(s)+O2(g)==CO2(g) △H= ―393.5kJ/mol
2H2(g)+O2(g)==2H2O(g) △H= ―483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是( )
A.1:1 B.1:2 C.2:3 D.3:2
9.已知热化学方程式:2SO2(g)+ O2(g)  2SO3(g) △H = ―196.64kJ/mol,在容器中充入8molSO2和1molO2充分反应,最终放出的热量为 ( )
2SO3(g) △H = ―196.64kJ/mol,在容器中充入8molSO2和1molO2充分反应,最终放出的热量为 ( )
A.196.64kJ B.<98.32kJ/mol C.<196.64kJ D.>196.64kJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com