
题目列表(包括答案和解析)
1. 10.8g氮的氧化物NxOy 和50g灼热的铁在密闭真空容器中反应一段时间后,生成0.1mol Fe3O4和0.1mol N2,则NxOy是
A.NO B. N2O3 C. NO2 D.N2O5
1.某化肥厂用氨气制备硝酸铵。已知氨制一氧化氮的产率为96%;一氧化氮制硝酸的产率为92%,硝酸和氨气反应得到硝酸铵。问制硝酸所用去氨气占总消耗氨气的质量分数得多少?(提示N 元素是否守恒)
化学方程式配平和过量多步反应计算测试
2.守恒法:
不追究中间过程,只从始态与终态时各元素原子总数恒等的角度上进行整体思维,往往可以使问题简单化。
例题:利用1t含FeS280%的黄铁矿来制硫酸,假设反应过程中由二硫化亚铁转化为二氧化硫时,损失硫2%,由二氧化硫转化为三氧化硫时的利用率只有75%,则一吨黄铁矿,可制得95%的硫酸多少吨?
解析:工业上制硫酸有三步反应:
4FeS2 + 11O2==2Fe2O3 + 8SO2↑
2SO2 +O2 ==2SO3(条件要标明)
SO3 + H2O == H2SO4
以上三步据S计量关系可得:FeS2-2SO2-2SO3-2H2SO4
或者由S原子守恒可得:S-H2SO4
设可制得95%的硫酸质量为X则的如下关系:
FeS2 - 2H2SO4
120t 196t
1*80%*(1-2%)*75% X*95%
利用上下之比左右相等可求出X=1.01t
练习:
1. 关系法:
凡反应连续进行,上一步反应的产物为下一步反应的反应物再反应时,可用关系式法.
建立关系式的方法有:
A利用原子守恒建立
B利用方程式中化学计量数间的关系建立关系式
C叠加化学方程式来找关系式。
必须进行过量判断的情况:① 同时给出两种以上反应物的量;②同时给出两种反应物的总量;③同时给出一种反应物和一种产物的量;④同时给出反应前、后物质的差量与反应物的总量。
过量计算解题要点:
①将已知量与化学元素方程式中相关量这比作比较后直接断过量;
②根据实际变化量(不足的量)利用化学方程式计算。
过量计算的实用方法
例题:25克纯度为80%的石灰石与100克质量分数为15%的稀盐酸充分反应,试确定反应生成二氧化碳的质量。
解析:(1)比值法:已知量比关系量,比值大者过量。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100克 73克
25*80%克 100*15%克
因为25*80%/100〈100*15%/73所以盐酸过量。计算二氧化碳的量应按碳酸钙来计算。
(2)十字相乘法:关系量与已知量交叉相乘,积大者所含已知量对应物质过量。
CaCO3 + 2HCl=CaCl2+H2O+CO2↑
100克 73克
25*80%克 100*15%克
因为100*100*15%>73*25*80%前者所含已知量为盐酸,所以HCl过量.按碳酸钙计算:
(3)假设法:假设一种物质完全反应完(设为A物质),以它为标准计算所需另一种物质(设为B 物质)的量,若计算所得值比实际值大,则A物质过量;若计算所得值比实际小,则B物质过量.
假设碳酸钙完全反应完,需消耗盐酸的质量为X,则
CaCO3 + 2HCl==CaCl2+H2O+CO2↑
100克 73克
25*80%克 X
X==25克*80%*73克/100克==14.6克
因为14.6克<100克*15%=15克,碳酸钙反应完了,而盐酸还有剩余,所以盐酸过量.应按碳酸钙的量来计算二氧化碳.
(4)用差量法来判断过量问题
此类方法告诉我们的是已知两反应物的总量和反应后的剩余量。反应前后出现了差量。我们用差量法来计算:
习题:
在1.00L1.00mol/L氢氧化钠溶液中通入16.8L标准状况下的二氧化碳,计算所得溶液中含有的碳酸氢钠和碳酸钠的物质的量是多少?
5、离子方程式的配平
离子方程式配平依据方程式左右两边质量守恒和电荷守恒定律。
练习: Fe (OH)3+ + ClO- + OH- - FeO + Cl- + H2O
4、缺项配平
缺项物质原则是:
① 一般作为反应物是介质:酸、碱、水,不参加氧化还原反应。
② 若果在酸性或碱性介质中反应,作为生成物则为水。
③ 缺什么,补什么。先看元素种类,若无所缺元素,则化合价升降后看原子个数的差
例2:配平:
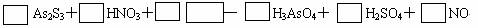
解析:显然,左边少H、O,应有水。稀HNO3被还原为NO,此式合理。
As2S3+ HNO3+ H2O - H3AsO4+ H2SO4+ NO
As2S3和HNO3标准物,可以用化合价升降一次配平。
3As2S3+28HNO3+4H2O = 6H3AsO4+9H2SO4+28NO
 练习
练习
3、多元素同时发生氧化还原的反应化合价加和整体配平
练习 Cu2S + HNO3 - Cu(NO3)2 +NO +H2SO4 + H2O
2、“归中”反应必须从反应物配起
练习 FeCl3 + Fe - FeCl2
1、部分氧化还原反应、自身氧化还原反应逆向配平
例1 Zn + HNO3--Zn(NO3)2 + NH4NO3 + H2O
分析:该反应中HNO3部分被还原,其系数应为变与不变之和。对于这类部分氧化还原反应,宜从反应物和生成物同时着手,先确定Zn和NH4NO3的系数。

确定了Zn和NH4NO3的系数分别为4和1之后,再用观察法配平Zn(NO3)2、HNO3、H2O的系数依次为4、10、3。
练习 I2 + KOH - KI + KIO3 + H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com