
题目列表(包括答案和解析)
7. 盐类水解离子反应方程式的书写,注意“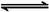
 ”号的用法。
”号的用法。
如:FeCl3溶液,Fe3++3H2O 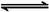
 Fe(OH)3+3H+。
Fe(OH)3+3H+。
6.电解质溶液中的离子浓度四大关系
(1)各离子浓度大小关系;(2)物料守恒;(3)电荷守恒;(4)质子守恒c(H+)水=c(OH-)水(质子守恒=物料守恒-电荷守恒)。
注:在弱酸的酸式盐溶液中,质子守恒中要注意弱酸的酸式酸根离子电离出的H+浓度。如在NaHCO3溶液中:c(OH-)=c(H2CO3)+c(H+)-c(CO)。
5.(1)检验溶液的性质:取一小块试纸在表面皿或玻璃片上,用蘸有待测液的玻璃棒或胶头滴管点滴于试纸的中部,观察颜色的变化,判断溶液的性质。
(2)检验气体的性质:先用蒸馏水把试纸的一端润湿,粘在玻璃棒的一端,用玻璃棒将试纸靠近气体,观察颜色的变化,判断气体的性质。也可用干净的镊子夹取试纸。
(3)红色或蓝色石蕊试纸、淀粉KI试纸使用时则要先湿润。
4. 影响水电离的因素
水的电离是电离平衡的一种具体表现形式。
(1)温度:由于水的电离过程吸热,故升温使水的电离平衡右移,即加热能促进水的电离,c(H+)、c(OH-)同时增大,KW增大,pH变小,但c(H+)与c(OH-)仍相等,故体系仍显中性。
(2)酸、碱性:在纯水中加入酸或碱,酸电离出的H+或碱电离出OH-均能使水的电离平衡左移,即酸、碱的加入抑制水的电离。
若此时温度不变,则KW不变,c(H+)、c(OH-)此增彼减。
即:加酸,c(H+)增大,c(OH-)减小,pH变小;加碱,c(OH-)增大,c(H+)减小,pH变大。
(3)能水解的盐:在纯水中加入能水解的盐,由于水解的实质是盐电离出的弱酸酸根离子或弱碱阳离子结合水电离出的H+或OH-,所以盐的水解必破坏水的电离平衡,使水的电离平衡右移。即盐类的水解促进水的电离。
(4)其他因素:向水中加入活泼金属,由于其与水电离出的H+直接作用,因而同样能促进水的电离。
3.“酸与碱反应二者恰好中和”与“酸与碱反应得溶液呈中性”,
还有“酸碱中和滴定实验达终点。”
2.“溶液呈中性”和“溶液的pH=7”。
1.“pH相同的盐酸和醋酸”与“物质的量浓度相同的盐酸和醋酸”。
8. 盐类水解的应用
(1)判断离子浓度;(2)判断离子共存;(3)判断弱电解质相对强弱;(4)盐溶液配制;(5)物质的鉴别与除杂;(6)制备胶体;(7)明矾净水;(8)泡沫灭火器原理、草木灰不能与铵态氮肥混合使用;(9)试剂存放:如Na2CO3溶液不能用磨口玻璃塞的试剂瓶存放;(10)判断水解盐溶液受热产物。
注意:
7.水解平衡的因素
影响水解平衡进行程度最主要因素是盐本身的性质。
①组成盐的酸根对应的酸越弱,水解程度越大,碱性就越强,PH越大;
②组成盐的阳离子对应的碱越弱,水解程度越大,酸性越强,PH越小;
外界条件对平衡移动也有影响,移动方向应符合勒夏特列原理,下面以NH4+水解为例:
①.温度:水解反应为吸热反应,升温平衡右移,水解程度增大。
②.浓度:改变平衡体系中每一种物质的浓度,都可使平衡移动。盐的浓度越小,水解程度越大。
③.溶液的酸碱度:加入酸或碱能促进或抑制盐类的水解。例如:水解呈酸性的盐溶液,若加入碱,就会中和溶液中的H+,使平衡向水解的方向移动而促进水解;若加入酸,则抑制水解。
同种水解相互抑制,不同水解相互促进。(酸式水解--水解生成H+;碱式水解--水解生成OH-)
6.盐类水解的离子反应方程式
因为盐类的水解是微弱且可逆的,在书写其水解离子反应方程式时应注意以下几点:
(1)应用可逆符号表示,
(2)一般生成物中不出现沉淀和气体,因此在书写水解离子方程式时不标“↓”“↑”
(3)多元弱酸根的水解分步进行且步步难,以第一步水解为主。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com