
题目列表(包括答案和解析)
3. 对于1 mol·L-1的氨水,下列叙述中正确的是(忽略溶液混合时的体积变化)( )
A.将标准状况下22.4 L氨气溶于水配成1 L溶液,即可得到1 mol·L-1的氨水
B.1 mol·L-1的氨水的质量分数小于1.7%
C.1 mol·L-1的氨水与水等质量混合后,所得氨水的物质的量浓度大于0.5 mol·L-1
D.将1 mol·L-1的氨水与3 mol·L-1的氨水等质量混合后,所得氨水的物质的量浓度为2 mol·L-1
解析:选项A:由于氨水中的溶质即为溶入的氨气,而标准状况下22.4 L氨气为1 mol,因此,将1 mol氨溶于水配成1 L溶液的物质的量浓度为1 mol·L-1;选项B:因为氨水的密度小于1 g·cm-3,故w>1.7%;选项C:若将1 mol·L-1的氨水与水等体积混合,所得氨水的浓度为0.5 mol·L-1,由于氨水的密度比水小,因此相同质量的水的体积比氨水小,故等质量混合后所得氨水的物质的量浓度大于0.5 mol·L-1;选项D:因氨水的浓度越大,其密度越小,则等质量混合时,3 mol·L-1的氨水所占体积比1 mol·L-1的氨水大,故所得氨水的物质的量浓度大于2 mol·L-1。
答案:AC
2.某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
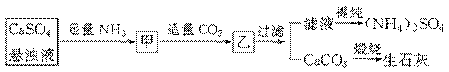
下列推断不合理的是( )
A.直接蒸干滤液得到纯净的(NH4)2SO4 B.生成1 mol (NH4)2SO4至少消耗2 mol NH3
C.CO2可被循环使用 D.往甲中通适量CO2有利于(NH4)2SO4生成
解析:该工艺流程原理较明确,B、C、D正确,如果直接蒸干滤液,由于滤液中还存在少量的杂质,这样得不到纯净的(NH4)2SO4。
答案:A
1.下列方法中不宜用浓HNO3作试剂的是( )
A.判断黄金首饰中是否掺有铜 B.实验室制取二氧化碳
C.除去镀在铝表面的铜镀层 D.配制溶解金的王水
解析:常温下只有浓、稀硝酸能溶解铜,但稀硝酸也会溶解铝,只有浓硝酸能使铜溶解、铝钝化。实验室制取二氧化碳应选用稀硝酸,否则生成的CO2气体中会混有较多的HNO3(g)。
答案:B
12. (2009·潍坊统考)中学常见的某反应的化学方程式为A+B―→C+D+H2O(未配平,反应条件略去)。请回答下列有关问题:
(1)若A是铁,B是稀硝酸(过量),且A可溶于C溶液中。则A与B反应的离子方程式为________________________________________________________________________。
(2)若C、D均为气体,且都能使澄清石灰水变浑浊,则上述反应的化学方程式为________________________________________________________________________。
(3)若C是无色刺激性气味的气体,其水溶液呈弱碱性,C能发生催化氧化反应。写出该反应的化学方程式________________。
(4)若D为氯碱工业的主要原料,C是造成温室效应的主要气体之一,则上述反应的化学方程式________________________。
解析:利用反应的特点和元素化合物知识解答。
答案:(1)Fe+4H++NO===Fe3++NO↑+2H2O
(2)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
(3)2NH4Cl+Ca(OH)22NaCl+2NH3↑+2H2O
(4)Na2CO3+2HCl===2NaCl+H2O+CO2↑或NaHCO3+HCl===NaCl+H2O+CO2↑

11. 在100 mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,如图表示加入的混合物的质量与产生的气体体积(标况)的关系,试计算:
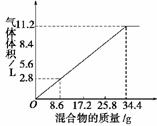
(1)NaOH溶液的物质的量浓度为____________。
(2)当NaOH溶液的体积为140 mL,固体混合物的质量是51.6 g时,充分反应后,生成气体的体积(标况)为________L。
(3)当NaOH的溶液的体积为180 mL,固体混合物的质量仍为51.6 g时,充分反应后,生成气体的体积(标况)为________L。
解析:(1)从图上看出34.4 g混合物和100 mL NaOH恰好完全反应。
n(NaOH)=n(NH3)==0.50 mol,c(NaOH)===5.0 mol·L-1;
(2)V(NaOH)=140 mL,因固体过量,所以V(NH3)=22.4 L/mol×n(NaOH):=22.4
L·mol-1×5 mol·L-1×0.14 L=15.68 L;
(3)V(NaOH)=180 mL,过量,固体51.6 g完全反应,=,V(NH3)=16.8 L
答案:(1)5.0 mol·L-1 (2)15.68 (3)16.8
10.某研究性学习小组在做氯气的喷泉实验时(装置如下图),发现含有酚酞的NaOH溶液喷入烧瓶后溶液的红色退去。甲、乙两位同学对此现象分别做了如下推测:
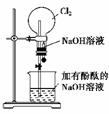
甲:因为氯气与NaOH溶液反应,使溶液碱性减弱甚至呈酸性,所以溶液红色退去。
乙:因为氯气溶于水并与水反应生成HClO,由于HClO的氧化漂白作用而使溶液退色。
(1)验证甲同学的推测是否正确的方法是________________________________________________________________________。
验证乙同学的推测是否正确的方法是________________________________________________________________________。
(2)如果将NaOH溶液改成酸性KMnO4溶液,把Cl2换成SO2气体,试问用图示所给装置完成喷泉实验是否合理?______(填“合理”或“不合理”)。如果认为不合理,请说明你的理由:________________________________________________________。
(3)类似“退色喷泉实验”还有多种“变色的喷泉实验”。请你按实验要求,分别设计1个“变色喷泉实验”并填写下列表格:
|
编号 |
实验要求 |
烧杯中的溶液 |
滴管中的液体 |
烧瓶中的气体 |
|
① |
无色变红色的喷泉 |
|
H2O |
|
|
② |
红色变无色的喷泉 |
|
|
SO2 |
解析:本题是将教材上的演示实验进行了改进和拓展,并与实验探究问题结合在一起。探究验证氯气使含酚酞的氢氧化钠退色的原因。若乙同学的说法正确,则说明酚酞被氧化,再加入氢氧化钠不会变红色;而如果甲同学正确,再加入氢氧化钠溶液会变红色。用高锰酸钾溶液和SO2进行喷泉实验,要考虑药品对仪器的影响,由于高锰酸钾具有强氧化性,会使橡胶(连接玻璃管的橡胶管、胶头滴管)氧化腐蚀,因此,该实验不合理。无色变红色是解题的关键,可以是含酚酞的水溶液遇氨气。红色变无色的情况可以是含酚酞的氢氧化钠溶液与氯化氢气体或SO2(也就是酸性气体)相遇。
答案:(1)取烧瓶中的无色溶液加入足量的NaOH溶液,如果溶液恢复红色,则可证明甲同学的推测是正确的 如果加入足量的NaOH溶液后不能恢复红色,则说明乙同学的推测是正确的
(2)不合理 KMnO4溶液可与橡胶塞反应,也不能盛放在倒置的胶头滴管中
(3)(其他合理答案也可)
|
编号 |
实验要求 |
烧杯中的溶液 |
滴管中的液体 |
烧瓶中的气体 |
|
① |
无色变红色的喷泉 |
酚酞试液 |
H2O |
NH3 |
|
② |
红色变无色的喷泉 |
NaOH(含酚酞)溶液 |
NaOH溶液 |
SO2 |
9. 如图所示,将Ⅰ中生成的NH3缓缓经过Ⅱ通入充满干燥Cl2的试管Ⅲ中,已知2NH3+3Cl2===N2+6HCl,试回答下列问题:
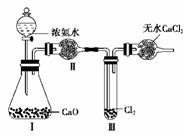
(1)Ⅰ中能产生NH3的理由(用相关化学用语简要回答):
________________________________________________________________________。
(2)Ⅱ中装的试剂是________;作用是__________________________________。
(3)Ⅲ中的现象是________________;恰好反应后,将Ⅲ试管倒立于盛满水的水槽中,(不考虑其他因素影响)液面上升约为试管体积的________。
解析:(1)由于浓氨水中存在如下平衡:NH3+H2ONH3·H2ONH+OH-,将浓氨水加到固体CaO中,浓氨水中的H2O与CaO反应放出热量并产生OH-,促使上述平衡向生成NH3的方向移动,导致NH3的生成。
(2)所得的NH3中有杂质H2O,装置Ⅱ的干燥管内可盛放碱石灰除去之。
(3)Cl2具有氧化性,NH3具有还原性,二者相遇发生氧化还原反应生成N2和HCl,2NH3+3Cl2===N2+6HCl,过量的NH3与HCl反应生成NH4Cl固体,其总反应为:8NH3+3Cl2===N2+6NH4Cl,因此氯气所呈现的黄绿色逐渐消失,并产生白烟。恰好完全反应后试管内剩下1/3体积的N2,将试管倒立在盛满水的水槽中,试管的2/3充满水。
答案:(1)CaO+H2O===Ca(OH)2,放出热量并生成碱,使平衡NH3+H2ONH3·H2ONH+OH-左移,所以有氨气生成。或写CaO+NH3·H2O===Ca(OH)2+NH3↑ (2)碱石灰 干燥氨气
(3)黄绿色逐渐消失并产生白烟
8.下图中各物质均由常见元素(原子序数≤20)组成。已知A、B、K为单质,且在常温下A和K为气体,B为固体。D为常见的无色液体。I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生。J是一种实验室常用的干燥剂。它们的相互转化关系如下图所示(图中反应条件未列出)。
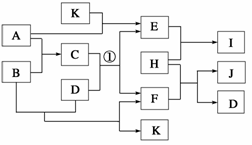
请回答下列问题:
(1)I的化学式为________;J的化学式为________。
(2)反应①的化学方程式为______________________________________。
(3)F的水溶液与氯气反应的离子方程式为________________________________________________________________________。
解析:根据I是一种中加入AgNO3产生不溶于硝酸的白色沉淀可推出I为NH4Cl,从而逆推E和H分别为NH3和HCl中的一种,由于H与F可以制J(常用干燥剂),从而推知E为NH3,H为HCl,进而推出J为CaCl2,并能逆推F为Ca(OH)2,D为H2O,由B和D(水)反应生成K和F,且A和K反应生成E(NH3)知K为氢气,则A为N2,再由F为Ca(OH)2(已推出)推知C中含有Ca元素,从而推知C为Ca3N2、B为Ca,至此可以做出答案。
答案: (1)NH4Cl CaCl2
(2)Ca3N2+6H2O===3Ca(OH)2+2NH3↑
(3)Cl2+2OH-===ClO-+Cl-+H2O
7.无色的混合气体甲可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过下图所示系列实验处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )

A.NH3、NO2、N2 B.NH3、NO、CO2
C.NH3、NO2、CO2 D.NO、CO2、N2
解析:根据甲为无色气体,推断甲中不存在NO2;甲气体通过浓H2SO4后气体体积减小,说明甲中含有NH3,且V(NH3)=20 mL;剩余气体通过足量Na2O2后气体变成红棕色,说明甲中存在NO和CO2,且CO2与Na2O2反应产生的O2使NO转变为NO2;由于气体通入水中时没有气体剩余,所以V(NO2)∶V(O2)=4∶1;根据2CO2+2Na2O2===2Na2CO3+O2,2NO+O2===2NO2,
当V(NO2)∶V(CO2)=4∶1时,V(NO)∶V(CO2)=2∶3,所以V(NO)=80 mL×=32 mL,V(CO2)=80 mL-32 mL=48 mL。
答案:B
6.相同状况下,在容积相同的三个烧瓶内分别充满干燥的NH3、HCl、NO2气体,然后按上述顺序分别用水做喷泉实验。实验结束后,烧瓶内三种溶液的物质的量浓度之比为( )
A.3∶3∶2 B.2∶2∶3 C.1∶1∶1 D.无法比较
解析:NH3和HCl作喷泉实验时所得溶液体积即为气体的体积,所得溶液的浓度均为 mol/L;NO2作喷泉实验时发生如下反应:3NO2+H2O===2HNO3+NO,则消耗的NO2的物质的量与生成HNO3的物质的量相同,所得溶液的浓度为:c== mol/L= mol/L。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com