
题目列表(包括答案和解析)
5. 将盛有1 mol NO和NO2的混合气体的试管倒立于水槽中,再通入0.4 mol O2,充分反应后,水便会充满整个试管。则原混合气体中NO与NO2体积比为( )
A.1∶2 B.2∶5 C.3∶7 D.无法确定
解析:方法一:设1 mol NO和NO2的混合气体中有a mol NO和(1-a) mol NO2,根据4NO+3O2+2H2O===4HNO3和4NO2+O2+2H2O===4HNO3可以列出:a+=0.4.∴a=0.3,V(NO)∶V(NO2)=3∶7。
方法二:由于NO、NO2和O2恰好与水反应,必然满足n(N)∶n(O)=2∶5,设有a mol NO,那么就有n(O)=a+2(1-a)+0.4×2=2.5[因为n(N)=1],∴a=0.3,即V(NO)∶V(NO2)=3∶7。
答案:C
4.溶液浓度和密度之间存在一定的关系,大部分浓度越大,密度越大,但也有特殊的,例如:氨水的浓度越大,密度反而越小,现用密度为0.91 g·cm-3的氨水,质量分数为25%,若将此氨水用等体积的水稀释后,所得溶液的质量分数为( )
A.大于12.5% B.小于12.5% C.等于12.5% D.无法确定
解析:加水稀释时溶质的物质的量不变,设加入水的体积为V,稀释后的质量分数为w,密度为ρ′,则有:ρ氨水×V×25%=2V×ρ′×w
即ρ氨水×25%=2ρ′w,由于ρ′>ρ氨水,则w<12.5%。
答案:B
0.1 mol·L-1。根据电荷守恒有:c(H+)=2c(SO)+c(NO),c(NO)=1 mol·L-1-0.2
mol·L-1=0.8 mol·L-1。因酸溶液抑制H2O电离,原混合溶液中水电离出的c(H+)=
10-14 mol·L-1。
答案:C
3.25℃时,20.00 mL硫酸和硝酸的混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,可得0.466 g沉淀。滤液跟2.00 mol/L氢氧化钠溶液反应,共用去10.00 mL碱液时恰好中和。下列说法中正确的是( )
A.原混合液中c(SO)=0.20 mol/L B.原混合液中c(NO)=0.90 mol/L
C.原混合液中pH=0 D.原混合液中由水电离出的c(H+)=0.10 mol/L
解析:H2SO4、HNO3混合液在与BaCl2溶液反应后生成0.466 g(0.002 mol)BaSO4,而H+的量没有变化。根据H++OH-===H2O,原溶液中n(H+)=0.01 L×2.00 mol·L-1=0.02 mol,c(H+)=0.02 mol/0.02 L=1 mol·L-1,pH=0。c(SO)=0.002 mol/0.02 L=
2.离子的检验和鉴别有多种方法,其中最常用的方法有以下三种:
|
检验方法 |
沉淀法 |
显色法 |
气体法 |
|
含义 |
反应中有沉淀产生或溶解 |
反应中有颜色变化 |
反应中有气体产生 |
下列离子检验的方法不合理的是( )
A.NH-气体法 B.I--沉淀法 C.Fe3+-显色法 D.Ca2+-气体法
解析:根据本题给出的三种方法的实质,Ca2+应该用沉淀法检验。
答案:D
1.(2009·上海单科,4)用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是( )
①幕布的着火点升高 ②幕布的质量增加 ③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①② B.③④ C.①③ D.②④
解析:氯化铵分解时吸收热量,使环境周围温度降低,达不到幕布的着火点,且分解产生的气体可隔绝空气使幕布不易着火。
答案:B
19. 有X、Y、Z、W、M五种短周期元素,它们满足如下关系:①原子序数依次增大;②ZX+WX-===ZX3+X2W,且反应物和产物中各微粒的电子总数与M+相等;③Z2与YW分子中质子数相等。回答下列问题:
(1)M单质的蒸气中存在着少量的双原子分子,其电子式为________;实验室中MWX的保存方法是________________。
(2)由X、Y、Z、W四种元素组成的离子化合物A,其原子个数比为7∶2∶1∶2,则A为________(写名称),A的水溶液的pH约等于7,其原因是________________。
(3)化学式为X5Y2ZW2的化合物B既能与盐酸反应,又能与NaOH溶液反应,且在一定条件下可形成高分子化合物,则B的结构简式为________。
(4)M2W2与FeSO4按物质的量之比1∶2混合溶于水中,反应的离子方程式为________________________________________________________________________。
(5)与M同族的元素M′和M2′W共n g投入到足量的X2W中完全反应,生成物蒸干后得1.25n g化合物M′WX,M′是________(填元素名称)。
解析:(1)反应“ZX+WX-===ZX3+X2W”,只能是NH+OH-===NH3+H2O,则X为H,Z为N,W为O,电子数与NH、OH-、NH3、H2O相等的M+为Na+,M为Na。由Z2与YW质子数相等,可知Y为C,MWX为NaOH。(2)分子式为C2H7O2N的A为CH3COONH4,其所含CH3COO-与NH的水解程度相近,导致溶液pH约等于7。(3)B的分子式为C2H5O2N,既能与盐酸反应又能与NaOH溶液反应且在一定条件下可生成高分子化合物的物质只能是H2NCH2COOH。
(4)Na2 2“”,SO43+,Na2O2为1 mol而FeSO4为2 mol时化合价升降相等,此时反应可表示为1Na2O2+2FeSO4+xH2O===yNa2SO4+zFe2(SO4)3+mFe(OH)3↓,据Na+守恒知y=1,再据SO守恒知z=1/3,进一步据Fe3+守恒知m=4/3,最后据H+守恒知x=2,整理后改写得到的离子方程式为3Na2O2+6Fe2++6H2O===6Na++4Fe(OH)3↓+2Fe3+。
(5)设M′的相对原子质量为R,利用极限值法求解:
若n g的物质全为M′时
M′―→M′OH
R R+17
n 1.25n
则=,解得R=68。
若n g物质全为M′2O时
M′2O―→2MOH
2R+16 2R+34
n 1.25n
则:=,解得R=28。
因为n g物质为M′与M′2O的混合物,故28<R<68,与Na同族的元素中只有K符合要求。
答案:(1)Na∶Na 密闭保存在带橡胶塞的试剂瓶中 (2)醋酸铵(乙酸铵) CH3COO-水解与NH水解程度相当 (3)H2NCH2COOH (4)3Na2O2+6Fe2++6H2O===6Na++4Fe(OH)3↓+2Fe3+ (5)钾
18.A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素最外层电子数是其次外层电子数的倍,A、B、D、E这四种元素,每一种与C元素都形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)写出下列元素的元素符号:B________,C________。
(2)用电子式表示D、E所形成的化合物:________。
(3)E的最高价态与A、B、C三种元素形成的酸式盐Y的化学式是________,该盐在水溶液中离子浓度由大到小的顺序是________。
(4)常温时,B元素的最高价氧化物对应水化物Z的溶液与盐X的溶液的pH均为a,则这两种溶液中由水电离出来的H+浓度c1(H+)∶c2(H+)=________。
解析:A为H,B为N,因HNO3+NH3===NH4NO3。D与A同主族,则D为Na,则E为第三周期元素,其次外层电子数为8,最外层电子数为×8=6即E为S,能与H、N、Na、S形成元素的原子个数比不相同的若干化合物的元素C应为O。对(3),E(S)的最高价为+6,与H、N、O三种元素形成的酸式盐为NH4HSO4,电离方程式为NH4HSO4===NH+H++SO,又NH能发生水解NH+H2ONH3·H2O+H+,故离子浓度最大的是H+,其次是SO,再次是NH,OH-最小。Z为HNO3,X为NH4NO3;对HNO3溶液,当pH=a时,水电离出的c(H+)=c(OH-)==10a-14 mol·L-1;对NH4NO3溶液,当pH=a时,水电离出的H+浓度为10-a mol·L-1,两者的比值为102a-14。
答案:(1)N O (2)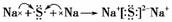
(3)NH4HSO4 c(H+)>c(SO)>c(NH)>c(OH-) (4)102a-14
17. 有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下:
|
② |
|
|
|
|
|
|
⑦ |
⑧ |
②与⑦、②与⑧形成的液体化合物是常见的重要溶剂,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:________________(用化学式表示)。
a
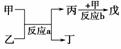
(2)若甲、乙、丙、丁、戊均为上述八种短周期元素中的某些元素组成的单质或由其中两种元素组成的化合物,且甲、戊为无色气体,反应a为置换反应,反应b为化合反应。如图所示转化关系,推测:戊可能为:________________、________________(列举合适的两例)。
若甲是O2、乙是N2H4,反应a是在强碱性溶液中进行的原电池反应,则负极发生的电极反应式为:_____________________________________________________________。
b
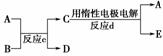
(3)若右图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物。已知:A是常见的金属单质,反应c为置换反应。若反应c是用A作电极,在B的水溶液中进行电解反应,它们有如右图示转化关系。则反应d中阴极的电极反应式为:__________________________________________________________。
若反应c是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物时,则反应c的化学方程式为:______________________________________。
解析:因②与⑦、②与⑧形成的液体化合物是常见的重要溶剂,结合其在元素周期表中的相对位置可以推出②为碳,⑦为硫,⑧为氯;其最高价氧化物对应水化物的酸性强弱的顺序是HClO4>H2SO4>H2CO3;(2)因反应a为置换反应,所以甲、乙、丙、丁四种物质中有两种是单质,两种是化合物,设甲为氧气,乙可能是氨气或硫化氢或甲烷等气态烃,丙则可能为氮气、硫或C,丁为水,戊为NO或SO2或CO、CO2等;若甲为CO2,则乙可能为Mg,丙可能为C,丁可能为MgO,戊可能为CO;若甲是O2、乙是N2H4,则在强碱性溶液中进行的反应a的原电池反应的负极反应式为N2H4+4OH--4e-―→N2+4H2O。(3)若反应c是用A作电极,在B的水溶液中进行电解反应的置换反应,结合反应d的生成物,可以确定A可能为铜等活动性相对较弱的金属,B的水溶液可能为硫酸、盐酸等酸溶液,C为可溶性铜盐或相应金属的盐溶液,D为氢气;若A为铜时,则反应d中阴极的电极反应式为Cu2++2e-―→Cu;若反应c是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物,可联想到铝热反应,其常见的化学方程式为Fe2O3+2Al2Fe+Al2O3。
答案:(1)HClO4、H2SO4、H2CO3 (2)CO、SO2、NO(任举两例,其他合理答案也可) N2H4+4OH--4e-―→N2+4H2O (3)Cu2++2e-―→Cu(或Zn2++2e-―→Zn、Ni2++
2e-―→Ni);Fe2O3+2Al2Fe+Al2O3
16.X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如右图所示的变化:
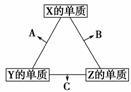
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。
请回答下列问题:
(1)X元素在元素周期表中的位置是________。
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入________(填物质名称);负极电极反应式为________________________。
(3)C在一定条件下反应生成A的化学方程式是________________。
(4)X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W溶液吸收生成一种盐。该盐的水溶液的pH________7(填“大于”“小于”或“等于”),其原因是(用离子方程式表示):________________。
(5)已知Y的单质与Z的单质生成C的反应是可逆反应,ΔH<0。将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是________(填写下列各项的序号)。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中,混合气体平均相对分子质量减小
e.达到化学平衡后,再升高温度,C的体积分数增大
解析:除惰性气体外,短周期的无色气体只有H2、N2、O2,由此不难确定X为O,Y为N,Z为H。
(5)设反应开始一段时间后生成NH3 x mol。
N2 + 3H22NH3
反应前 a mol a mol 0
反应后 a- a-x x
则反应后N2的体积分数为=50%。
答案:(1)第二周期ⅣA族 (2)氧气 H2+2OH--2e-―→2H2O (3)4NH3+5O2高温催化剂4NO+6H2O (4)小于 NH+H2O NH3·H2O+H+ (5)ab
NH3·H2O+H+ (5)ab
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com