
题目列表(包括答案和解析)
2.周期表中部分规律总结
(1).最外层电子数大于或等于3而又小于8的元素一定是主族元素;最外层电子数为1或2的元素可能是主族、副族或0族(He)元素;最外层电子数为8的元素是稀有气体元素(He除外)。
(2).在周期表中,第ⅡA与ⅢA族元素的原子序数差分别有以下三种情况:①第1-3周期(短周期)元素原子序数相差1;②第4、5周期相差11;③第6、7周期相差25。
(3).同主族相邻元素的原子序数差别有以下二种情况:①第ⅠA、ⅡA族,上一周期元素的原子序数+该周期元素的数目=下一同期元素的原子序数;②第ⅢA-ⅦA族,上一周期元素的原子序数+下一周期元素的数目=下一周期元素的原子序数。
(4).元素周期表中金属和非金属之间有一分界线,分界线右上方的元素为非金属元素,分界线左下方的元素为金属元素(H除外),分界线两边的元素一般既有金属性,也有非金属性。
(5).对角线规则:沿周期表中金属与非金属分界线方向对角(左上角与右下角)的两主族元素性质相似,这一规律以第二、三周期元素间尤为明显。
1.几个量的关系
周期数=电子层数
主族序数=最外层电子数=最高正价数
|最高正价|+|负价|=8
4.微粒半径大小比较规律
(1).同周期元素(稀有气体除外)的原子半径随原子核电荷数的递增逐渐减小。
(2).同主族元素的原子半径和离子半径随着原子核电荷数的递增逐渐增大。
(3).电子层结构相同的离子,核电荷数越大,则离子半径越小。
(4).同种元素的微粒半径:阳离子<原子<阴离子。
(5).稀有气体元素的原子半径大于同周期元素原子半径.
3.核外电子排布规律
(1).核外电子是由里向外,分层排布的。
(2).各电子层最多容纳的电子数为2n2个;最外层电子数不得超过8个,次外层电子数不得超过18个,倒数第三层电子数不得超过32个。
(3).以上几点互相联系。
2.同位素
(1)要点:同--质子数相同,异--中子数不同,微粒--原子。
(2)特点:同位素的化学性质几乎完全相同;自然界中稳定同位素的原子个数百分数不变。
1.几个量的关系(X)
质量数(A)=质子数(Z)+中子数(N)
质子数=核电荷数=原子序数=原子的核外电子数
离子电荷数=质子数-核外电子数
11.现有常温下0.1 mol·L-1的纯碱溶液。
(1)你认为该溶液呈碱性的原因是(用离子方程式表示):
________________________________________________________________________,
为证明你的上述观点,请设计一个简单的实验,简述实验过程:________________。
(2)甲同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO不超过其总量的10%,请你设计实验证明该同学的观点是否正确________________________________________________________________________。
(3)乙同学就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正确的是________。
A.c(Na+)=2c(CO)
B.c(CO)>c(OH-)>c(HCO)>c(H2CO3)
C.c(CO)+c(HCO)=0.1 mol·L-1
D.c(OH-)=c(H+)+c(HCO)+2c(H2CO3)
(4)水解反应是典型的可逆反应。水解反应的化学平衡常数称为水解常数(用Kh表示),请写出Na2CO3第一步水解反应的水解常数的表达式:________________。
解析:(1)Na2CO3呈碱性是由于CO水解造成的,离子方程式为:CO+H2O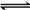

HCO+OH-,HCO+H2O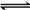
 H2CO3+OH-,要证明此观点,只须证明Na2CO3溶液中存在水解平衡即可。
H2CO3+OH-,要证明此观点,只须证明Na2CO3溶液中存在水解平衡即可。
(2)若CO的水解占其总量的10%,则由第一步水解反应得[OH-]=10-2 mol/L,因还有二级水解,故pH>12,要证明CO水解不超过总量的10%,只需看溶液pH是否小于或等于12即可。
答案:(1)CO+H2OHCO+OH-,HCO+H2OH2CO3+OH- 向加有酚酞的0.1 mol/L的Na2CO3溶液中加BaCl2,溶液红色退去 (2)取0.1 mol/L Na2CO3溶液,测其pH,小于或等于12 (3)B、D (4)Kh=
10.在氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其溶于水后加少量盐酸配制成水溶液,然后按下图所示的操作步骤进行提纯。
已知Cu2+、Fe2+在pH=4-5时不水解,而Fe3+几乎完全水解而沉淀。
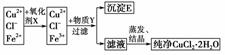
(1)为什么要加入氧化剂?________________。
(2)下列物质都可以作为氧化剂,其中最适合本实验的是________。
A.H2O2 B.KMnO4 C.NaClO D.K2Cr2O7
(3)物质Y是________,加入Y的目的________,沉淀E是________。
(4)欲将CuCl2·2H2O加热制得无水CuCl2,将采用什么方法和措施?________________________________________________________________________。
解析:根据题意及框图可知,加入氧化剂的目的是将Fe2+氧化为Fe3+,为了不引入杂质,选用“绿色”氧化剂H2O2,其反应为:H2O2+2Fe2++2H+===2Fe3++2H2O,加入Y的目的是调节pH为4-5之间,升高pH,为了不引入杂质可选用CuO、Cu(OH)2或CuCO3或Cu2(OH)2CO3,沉淀是Fe(OH)3。
由于Cu2+易水解,为防止水解可将晶体CuCl2·2H2O在HCl气氛中加热。
答案:(1)将Fe2+氧化为Fe3+ (2)A (3)CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3 调节pH,除去Fe3+ Fe(OH)3 (4)在HCl气氛下蒸发,以抑制CuCl2水解
9.在氯化铁溶液中存在下列平衡:
FeCl3+3H2O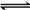
 Fe(OH)3+3HCl;ΔH>0
Fe(OH)3+3HCl;ΔH>0
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体。向这种液体中加入MgCl2溶液,产生的现象为______________________________。
(2)不断加热FeCl3溶液时,蒸干其水分并灼烧得到的固体可能是________________________________________________________________________。
(3)在配制FeCl3溶液时,为防止浑浊,应加入__________________________________。
(4)向FeCl3溶液中加入少量浓苯酚钠溶液,预计可能看到的现象是________________________________________________________________________。
解析:(1)加热FeCl3溶液,得到Fe(OH)3胶体,加入MgCl2使胶体凝聚而得到红褐色沉淀。
(2)加热可促进盐类水解,由于HCl挥发,可使水解进行彻底,得到Fe(OH)3沉淀,Fe(OH)3受热分解,最终产物为Fe2O3。
(3)为防止FeCl3水解,应加入少许稀盐酸抑制FeCl3水解。
(4)因 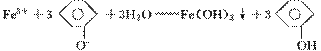 ,所以得到红褐色沉淀,同时与 FeCl3发生显色反应,溶液变为紫色。
,所以得到红褐色沉淀,同时与 FeCl3发生显色反应,溶液变为紫色。
答案:(1)有红褐色沉淀 (2)Fe2O3 (3)少许稀盐酸 (4)产生红褐色沉淀,溶液变为紫色
8.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol/L NaHSO3和NaHCO3的两种溶液,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的一组是( )
A.c(Na+)>c(HRO)>c(H+)>c(RO)>c(OH-)
B.c(Na+)+c(H+)=c(HRO)+c(RO)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO)+c(OH-)
D.c(Na+)=c(HRO)+c(H2RO3)+2c(RO)
解析:NaHSO3溶液呈酸性,NaHCO3溶液呈碱性,可知A不正确;据电荷守恒:c(Na+)+c(H+)=c(HRO)+2c(RO)+c(OH-),可知B不正确;据物料守恒:c(Na+)=c(HRO)+c(H2RO3)+c(RO),可知D不正确;将电荷守恒与物料守恒联立,消掉c(Na+)可得质子守恒:c(H+)+c(H2RO3)=c(RO)+c(OH-),可知C正确。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com