
题目列表(包括答案和解析)
7.已知某溶液中存在OH-、H+、NH、Cl-四种离子,某同学推测其离子浓度大小顺序有如
下四种关系:
①c(Cl-)>c(NH)>c(H+)>c(OH-) ②c(Cl-)>c(NH)>c(OH-)>c(H+)
③c(NH)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是________,上述四种离子浓度的大小顺序为________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________;若上述关系中④是正确的,则
溶液中的溶质为__________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl)______c(NH3·H2O)(填“大于”、“小于”或“等于”,下同),混合前酸中c(H+)和
碱中c(OH-)的关系为c(H+)______c(OH-)。
解析:(1)若溶液只有一种溶质,该溶质为NH4Cl,因NH水解溶液呈酸性,离子浓度的大
小关系为c(Cl-)>c(NH)>c(H+)>c(OH-)。
(2)因为c(OH-)>c(H+)、c(NH)>c(Cl-),所以溶液中除含有NH4Cl外,还必须含有NH3·H2O。
若c(Cl-)>c(H+)>c(NH)>c(OH-),则说明溶液中含有NH4Cl和HCl。
(3)NH4Cl水解溶液呈酸性,若等体积稀盐酸与氨水混合后呈中性,说明氨水过量,故
c(HCl)<c(NH3·H2O),混合前盐酸中c(H+)大于弱碱氨水中c(OH-)。
答案:(1)NH4Cl ① (2)NH4Cl和NH3·H2O NH4Cl和HCl (3)小于 大于
6. (2009·上海单科,14)根据以下事实得出的判断一定正确的是( )
A.HA的酸性比HB的强,则HA溶液的pH比HB溶液的小
B.A+和B-的电子层结构相同,则A原子的核电荷数比B原子的大
C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大
D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强
解析:A项,没有指明溶液浓度,溶液的pH无法比较;C项,没有指明是否是饱和溶液,A的盐溶液的溶质质量分数不一定比B的盐溶液的大;D项,还原性强弱是看原子失电子的难易而不是失去电子数目的多少。
答案:B
5.下列事实不属于盐类水解应用的是( )
A.明矾、氯化铁晶体常用于净水
B.实验室通常使用热的纯碱溶液去除油污
C.实验室配制FeCl3溶液时加入少量稀盐酸
D.实验室制氢气时加入CuSO4可加快反应速率
解析:A项,Al3+、Fe3+均能发生水解;B项,热碱液碱性强,容易使油脂水解;C项,加入HCl可抑制FeCl3水解;D项,Zn与置换出来的Cu在电解质溶液中构成原电池。
答案:D
4.MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中正确的是( )
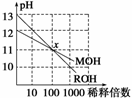
A.在x点时,ROH完全电离
B.在x点时,c(M+)>c(R+)
C.MOH是一种强碱
D.稀释前,c(ROH)=10 c(MOH)
解析:从稀释倍数与pH变化可以看出ROH是一种强碱,MOH是一种弱碱,则稀释前c(ROH)<10c(MOH)。
答案:A
3.(2008·全国理综Ⅰ,12)已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol/L的NaA和NaB混合溶液中,下列排序正确的是( )
A.c(OH-)>c(HA)>c(HB)>c(H+) B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+) D.c(OH-)>c(HB)>c(HA)>c(H+)
解析:在NaA和NaB的混合液中存在A-和B-的水解平衡:A-+H2O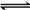 HA+OH-、
HA+OH-、
B-+H2O HB+OH-,同时由于HA比HB酸性弱,因此A-的水解程度大于B-的水解程度,故c(HA)>c(HB)、c(B-)>c(A-)>c(OH-),因此只有A正确。
HB+OH-,同时由于HA比HB酸性弱,因此A-的水解程度大于B-的水解程度,故c(HA)>c(HB)、c(B-)>c(A-)>c(OH-),因此只有A正确。
答案:A
2.(2008·海南,9)下列离子方程式中,属于水解反应的是( )

 A.HCOOH+H2O HCOO-+H3O+ B.CO2+H2O HCO+H+
A.HCOOH+H2O HCOO-+H3O+ B.CO2+H2O HCO+H+

 C.CO+H2O HCO+OH- D.HS-+H2O S2-+H3O
C.CO+H2O HCO+OH- D.HS-+H2O S2-+H3O
解析:A、B、D选项都是电离方程式,只有C为水解反应方程式。
答案:C
1.下列过程或现象与盐类水解无关的是( )
A.纯碱溶液去油污 B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深 D.浓硫化钠溶液有臭味
解析:纯碱去油污利用其水解显碱性;加热氯化铁溶液时促进FeCl3水解为红褐色Fe(OH)3
胶体,颜色加深;浓硫化钠溶液有臭味是因Na2S水解产生少量的H2S气体;而铁生锈主要
是Fe在潮湿条件下发生电化学腐蚀。
答案:B
21.物质A是一种高熔点化合物,不溶于硫酸、硝酸,却溶于氢氟酸;C是一种气体,D是白色胶状沉淀 ,E是白色固体。A、B、C、D、E的转化关系如右图所示:
根据图示关系回答:
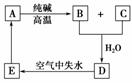
A是__________;B是__________;C是__________;D是__________;E是________。
解析:不溶于硫酸、硝酸,却能溶于氢氟酸的高熔点化合物是SiO2。它与纯碱在高温下反应生成Na2SiO3和CO2。因为H2CO3的酸性比H4SiO4强,所以Na2SiO3的水溶液与CO2反应生成白色胶状沉淀H4SiO4和Na2CO3。H4SiO4不稳定,在空气中立即失去水生成H2SiO3,H2SiO3受热分解产生SiO2。
答案:SiO2 Na2SiO3 CO2 H4SiO4 H2SiO3
20.在下图所示的物质相互转化关系中,A是一种固体单质,E是一种白色不溶于水的物质。据此填空。
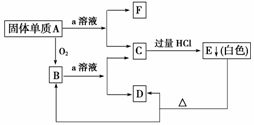
(1)写出各物质的化学式:
A__________、B__________、C____________、D________、E________、F________。
(2)B与a溶液反应的离子方程式是________________________________________________
________________________________________________________________________。
(3)A与a溶液反应的离子方程式是_______________________________________________。
解析:本题“突破口”是C中加入过量HCl产生不溶于盐酸的白色沉淀,推知E可能是硅酸。A可能是Si,代入题目验证,B为SiO2,能和Si和SiO2反应的溶液可能为HF溶液或NaOH溶液,结合题目知a溶液为NaOH溶液,C为Na2SiO3,D为H2O,F为H2。
答案:(1)Si SiO2 Na2SiO3 H2O H2SiO3 H2 (2)SiO2+2OH-===SiO+H2O
(3)Si+2OH-+H2O===SiO+2H2↑
19.矿泉水一般是由岩石风化后被地下水溶解其中的一部分生成的。此处所指的风化作用是指矿物与水和CO2作用的过程。例如,钾长石(KAlSi3O8)风化生成高岭土[Al2Si2O5(OH)4],此反应的离子方程式为2KAlSi3O8+2H2CO3+5H2O===2K++2HCO+4H2SiO3+Al2Si2O5(OH)4。
(1)将上述复杂硅酸盐改写成氧化物形式:
①KAlSi3O8____________________。
②Al2Si2O5(OH)4____________________。
(2)这个反应能够发生的原因是
________________________________________________________________________。
较活泼金属氧化物→较活泼金属氧化物→非金属氧化物→二氧化硅→水。
则KAlSi3O8为K2O·Al2O3·6SiO2 Al2Si2O5(OH)4为Al2O3·2SiO2·2H2O
(2)从方程式可知H2CO3制硅酸符合强酸制弱酸,所以这个反应能够发生。
答案:(1)①K2O·Al2O3·6SiO2 ②Al2O3·2SiO2·2H2O (2)因为碳酸酸性比硅酸强,由较
强的酸可制得较弱的酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com