
题目列表(包括答案和解析)
例1 现有Na2SO4和H2SO4的混合溶液100 mL,其中Na2SO4的浓度为0.5 mol/L ,H2 SO4的浓度为1 mol/L。现要将上述混合溶液中Na2SO4的浓度改为0.2 mol/L,H2SO4的浓度改为2 mol/L,应加入98%(密度为1.84 g/cm3)的浓H2SO4多少毫升?然后加水 稀释到多少毫升?
[解析]加98%H2SO4溶液和水稀释前后,溶质Na2SO4量不变
则设加水稀释到V mL
有关系:0.5×100=0.2×V V=250 mL
需加纯硫酸n(H2SO4)=0.25×2-0.1×1=0.4 mol
折算成98%(密度1.84 g/cm3)的硫酸体积为V=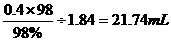
最后加水稀释至250 mL。
例2 已知常温时反应2Fe3++Cu=2Fe2++Cu2+在水溶液中能发生,将22. 4 g由铜和三氧化二铁组成的混合粉末加入到浓度为1 mol/L的硫酸中,使之发生反应。
(1)若固体恰好全部溶解,消耗硫酸的体积为V,求V的取值范围。
(2)若硫酸溶液过量,反应后溶液的体积为1 L,测得此溶液中Fe2+浓度为0.1 mol/L, 求原混合物中含铜多少克?
[解析]在有并列反应或连续反应的情况下,如果用字母表示反应物的用量,则需要进行多种情况的过量关系计算。一般来说,首先判断可能发生的反应,寻找界点,确定区域,然后在各个界点和区域范围内讨论求解。
(1)固体全部溶解,涉及的反应有:
①Fe2O3+3H2SO4=Fe2(SO4)4+3H2O ②Fe2(SO4)3+Cu=2FeSO4+CuSO4
可通过恰好反应的极端情况,寻找界点,假设固体中只有Fe2O3,反应仅按①式进行, 显然恰好反应时,应满足:1×V=3×22.4/160,解得V=0.42
假设固体是Cu和Fe2O3的混合物,反应按①、②两式进行,若要固体恰好溶解,物质的 量应满足:n(Cu)=n[Fe2(SO4)3]=n(Fe2O3)=x mol
依题意:64x+160x=22.4,解得x=0.1
由反应式①可得关系式 1×V=3×0.1,V=0.3
所以V的取值范围是:0.3<V<0.42
(2)溶液中n(Fe2+)=0.1 mol,它是由反应式②生成的,因为Fe2(SO4)3和Cu谁过量,题目中不明确,故需要加以讨论。
若Cu过量,则n(Fe2O3)=n[Fe2(SO4)3]=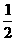 n(FeSO4)= 0.05 mol,Cu的质量为:22.4-n(Fe2O3)=22.4-0.05×160=14.4(g)
n(FeSO4)= 0.05 mol,Cu的质量为:22.4-n(Fe2O3)=22.4-0.05×160=14.4(g)
若Fe2(SO4)3过量,则n(Cu)=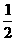 n(FeSO4)=0.05 mol,Cu的质 量为:0.05×64=3.2
(g)
n(FeSO4)=0.05 mol,Cu的质 量为:0.05×64=3.2
(g)
综上讨论,原混合物中铜的质量为14.4g或3.2 g。
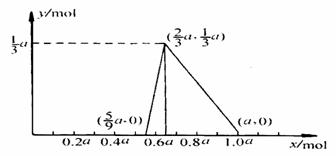
例3 把物质的量为a mol NH3、O2组成的混合气体,导入密闭反应器中,在催化剂存在下发生化学反应,若NH3、O2混合气中的O2为x mol,生成的HNO3为y mol。试确定x 在不同取值范围的y=f(x)函数表达式,并画出相应的函数图像。
[解析]氨气、氧气的混合气体在催化剂存在下发生反应的化学方程式是:
4NH3+5O2 4NO+6H2O
①
4NO+6H2O
①
当氧气过量时,反应①生成的一氧化氮又可继续氧化为二氧化氮:
2NO+O2 2NO2
②
2NO2
②
二氧化氮、氧气的混合气又可跟水反应,生成硝酸:
4NO+O2+2H2O 4HNO3
③
4HNO3
③
把上述反应①②③相加,可以得到氨气与氧气反应生成硝酸的化学方程式:
NH3+2O2 HNO3+H2O
④
HNO3+H2O
④
分析上述① 、④ 两个化学方程式,可以得知NH3与O2这两种反应物,在不同的物质的量之比时,发生的两个不同反应。
(1)当x≤5a/9时,按反应① 进行,NH3只能氧化至一氧化氮,没有硝酸生成,此时y=0。
(2)当x≥2a/3时,按反应④进行,(a-x)mol NH3可以全部转化为硝酸:
NH3+2O2 HNO3+H2O
HNO3+H2O
a-x (a-x) 所得硝酸的物质的量为:y=a-x
当x=2a/3mol时,生成HNO3的物质的量最大,其数值为a/3mol。
(3)当5a/9<x<2a/3时,反应按① ④ 进行。
设按反应①被氧化的NH3为b mol,按反应④被氧化的NH3为y mol
① ④ 两个反应消耗NH3的物质的量之和为:b+y=a-x
① ④ 两个反应消耗O2的物质的量之和为:5a/4+2y=x
解以上两方程组可得HNO3的函数表达式:y=3x-5a/3
(4)有关函数图像:
能力训练
1、把100g10%的Na2SO4溶液的质量分数增加到20%,可采取的方法是( )
①蒸发掉45g水 ②蒸发掉50g 水 ③加入10g Na2SO4固体 ④加入12.5gNa2SO4固体
A.①③ B.①④ C.②③ D.②④
4.考查学生对相关学科知识的运用能力及将中学各科知识形成网络和体系的能力。
3.从定量的角度上和在较高的深度上,来考查学生的思维品质,即思维的敏捷性、思维的严密性、思维的整体性和思维的创造性等。
2.掌握化学基本概念、基本理论及元素的单位和其重要的化合物、有机化学基础、化学实验等知识内容中,具有计算因素的各类问题的综合运用能力。
由于化学计算涉及的知识面广,对学生综合能力的考查最为明显,所以也是高考考查的热点 。化学计算要掌握的技能和技巧如下:
1.握有关化学量和化学式等基础知识的计算,并能熟练运用化学计算中的有关技能和技巧。
18、若以ω1和ω2分别表示浓度为a mol·L-1和b mol·L-1氨水的质量分数,且知b=2a,则下列推断正确的是( )
A.ω2 =2ω1 B.ω1=2ω2 C.ω2>2ω1 D.ω1<ω2<2ω1

17.某结晶水合物化学式X·nH2O,其相对分子质量为M,在25℃时,Ag该结晶水合物溶于Bg水中即可达到饱和,形成密度为D g/cm3的饱和饱和溶液VmL,下列表达式中不正确的是( )
A.该饱和溶液的质量分数为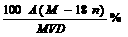
B.X在25℃时的溶解度为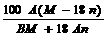
C.该饱和溶液的物质的量浓度为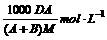
D.该饱和溶液的物质的量浓度为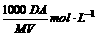
16.已知一种盐酸的物质的量浓度为M1,密度为d1g/cm3,体积为V1L,另一种盐酸的物质的量浓度为M2,密度为d2g/cm3,体积为V2L,两者混合后,溶液的密度为d3g/cm3,用数学式表示混合溶液的物质的量浓度是( )
A. B.
B.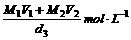
C.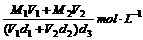 D.
D.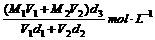
15.将标准状况下,将VL HX气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为ρg/cm3,则此溶液的物质的量浓度(mol/L)为( )
A.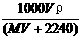 B.
B.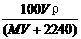
C.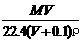 D.100VρM(MV+2240)
D.100VρM(MV+2240)
14.200mL 硫酸铁溶液中含有Fe3+为28g,取20mL溶液加水稀释到400 mL,则稀释后溶液中SO42-的物质的量浓度是( )
A.1/16mol/L B.3/16mol/L C.1/64mol/L D.0.2mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com