
题目列表(包括答案和解析)
30.(1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体,NiO(氧化镍)晶 体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算 NiO晶体的密度(已知NiO的摩尔质量为74.7g/mol)。
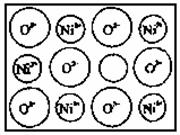
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如下图所
示的缺陷:一个Ni2+空缺,另两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值都发生了变化。某氧化镍样品组成为Ni O,试计算该晶体中Ni3+与Ni2+的离子数之比。
O,试计算该晶体中Ni3+与Ni2+的离子数之比。
29.现有一份CuO和Cu2O混合物,用H2还原法测定其中CuO的质量 x(g),实验中可以测 定如 下数据:W为混合物的质量(g),W(H2O)为生成H2O的质量(g),W(Cu)为生成Cu的质量(g ),V(H2)为消耗的H2标准状况下的体积(L)
(1)为了计算x,至少需要测定上述四个数据中的 个,这几个数据的组合共有
种,请将这些组合一一填入下表空格中。
说明:① 选用W、W(H2O)、W(Cu)、V(H2)表示,不必列出具体计算式。
② 每个空格中填一种组合,有几种组合就填几种,不必填满。
(2)从上述组合中选写一个含W的求x的计算式:x= 。
28.将某种碳酸钠晶体(Na2CO3·nH2O)和碳酸氢钠的混合物10.4 g加热到质量不再减 少时 还剩下残渣7.95 g。加热时产生的气体依次通过浓H2SO4与NaOH溶液,使NaOH溶液增重1 .1 g(假设气体全部被吸收)。求:
(1)混合物中NaHCO3质量分数;(2)Na2CO3·nH2O中n的值。
27.有氯化亚铁、氯化铜混合溶液400 mL,经测定其中Cl-浓度是a mol/L。投入过量的锌粉b g,充分反应后过滤,洗涤所得固体残渣并干燥,称知质量为c g
(1)求原混合溶液Fe2+、Cu2+的物质的量浓度 ;
(2)b的数值应> a g,其计算式如下: ;
(3)c的数值越大,说明混合溶液中氯化铜含量 ,c的最大值(以a、b表示)应 g。
26.常温下,将20.0 g 14.0%的NaCl溶液跟30.0 g 24.0%的NaCl溶液混合,得到密度为1.15 g/mL 的混合溶液。计算:
(1)该混合溶液中溶质的质量分数;
(2)该溶液的物质的量浓度;
(3)在1000 g水中需溶入多少摩NaCl,才能使其浓度恰与上述混合溶液的浓度相等?
25.将过量Mg粉溶于100 mL 1.5 mol/L 稀H2SO4中,反应结束后,滤去多余Mg粉,滤液在t℃下蒸发,当滤液质量为63 g时开始析出MgSO4·xH2O晶体,当析出晶体13.47 g时,剩下滤液40 g。求(1)生成MgSO4的物质的量;(2)t℃时该晶体的溶解度;(3)MgSO4· xH2O中的x值。
17.(2)若用NaOH(s)86 g,则需用水 g。
24.参照物质的溶解度,用NaOH(s)、水、CaCO3(s)、盐酸为原料制取33 g纯NaHCO3
|
物质 |
NaHCO3 |
Na2CO3 |
NaOH |
|
25℃的溶解度/g |
9 |
33 |
110 |
(1)若用水100 g,则制取时需用NaOH g。
23.有一包固体混合物,其中含硝酸钠和不溶性杂质。在其中加入一定量水,使其充分溶解 ,其溶解情况如下:
|
温度/℃ |
10 |
20 |
30 |
|
剩余固体/g |
201 |
132 |
72 |
试通过计算回答:
(1)此实验所加水的质量为多少克?
(2)原混合物中硝酸钠质量为多少克?
(3)欲完全溶解混合物中的硝酸钠,所需最低温度是多少?
硝酸钠溶解度表
|
温度/℃ |
10 |
25 |
40 |
50 |
55 |
60 |
65 |
70 |
80 |
|
溶解度/g |
81 |
92 |
104 |
114 |
117 |
124 |
130 |
150 |
166 |
22.充分燃烧50g黄铁矿粉末,然后将生成的SO2跟24gO2混合并在一定条件下发生反应,将反应后的气体先用冰水冷却,得40g无色晶体,剩余气体再与氢硫酸充分反应生成44g淡黄色沉淀。问:(1)SO2的转化率为多少?(2)黄铁矿含硫的百分率是多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com