
题目列表(包括答案和解析)
|
|
分子 |
离子 |
|
一核18电子的 |
Ar |
K+、Ca2+、Cl-、S2- |
|
二核18电子的 |
F2、HCl |
HS-、O22- |
|
三核18电子的 |
H2S |
|
|
四核18电子的 |
PH3、H2O2、H2NF |
|
|
五核18电子的 |
SiH4、CH3F、NH2OH |
PH4+ |
|
六核18电子的 |
N2H4、CH3OH |
|
|
七核18电子的 |
CH3NH2 |
|
|
八核18电子的 |
C2H6 |
|
|
|
分子 |
离子 |
|
一核10电子的 |
Ne |
N3-、O2-、F-、Na+、Mg2+、Al3+ |
|
二核10电子的 |
HF |
OH- |
|
三核10电子的 |
H2O |
NH2- |
|
四核10电子的 |
NH3 |
H3O+ |
|
五核10电子的 |
CH4 |
NH4+ |
35.(1)OH-向右移动 Na+向左移动 (2)0.3C 0.3C (3)2H2O 2H2+O2?
2H2+O2?
(4)电,化学,内,Iεt-I2(R+r)t
(5)(1)0.062(6.2%);4.75mol (6)19mol
34.(1)SO2+CaCO3+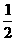 O2+2H2O
O2+2H2O CaSO4·2H2O+CO 2
CaSO4·2H2O+CO 2
SO2+Ca(OH)2+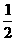 O2+H2O
O2+H2O CaSO4·2H2O
CaSO4·2H2O
(2) =10000×0.0015×24=360(m3)=3.6×105(dm3)
=10000×0.0015×24=360(m3)=3.6×105(dm3)
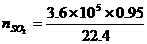 =15276.86(mol)
=15276.86(mol)
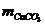 =15267.86×100=1526786(g)=1.53×103(kg)
=15267.86×100=1526786(g)=1.53×103(kg)
(3)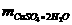 =15267.86×172=2626071.92(g)=2.63×103
=15267.86×172=2626071.92(g)=2.63×103
33.(1)要求由质量、摩尔质量以及体积、浓度分别列出酸和碱的物质的量,再根据中和反应中酸碱物质的量关系列式求得碱的浓度。
∵ 
∴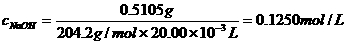
(2)在上题求得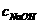 的基础上,同样利用酸碱中和反应,求得食醋稀释液中CH3COO H的物质的量,经换算后得出C3COOH%的表示式。
的基础上,同样利用酸碱中和反应,求得食醋稀释液中CH3COO H的物质的量,经换算后得出C3COOH%的表示式。
∵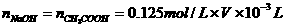
∵CH3COOH%=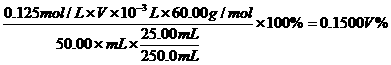
与第(1)题相比,由于需要经过换算以及正确理解CH3COOH%的含义,所以难度略有上升。 (3)要求学生能迅速接受并理解试题给出的两个信息,据此做出判断。这两条信息是:① 由第(1)上题得知,KHC8H4O4可以进一步与NaOH发生中和反应,说明KHC8H4O4溶
液呈酸性(从指示剂颜色变化可知,它与NaHCO3不同,NaHCO3是呈弱碱性的)。② 0.1mol /L邻苯二甲酸(H2C8H4O4)溶液的pH大于1,说明溶液的浓度大于电离出的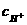 ,证明这是弱酸,既然是弱酸,当它完全中和后生成的正盐溶液应呈弱碱性(强碱弱酸盐 水解,溶液呈弱碱性),所以,邻苯二甲酸和KOH溶液混合后,若pH=7,说明邻苯二甲酸和第 一步中和反应(生成KHC8H4O4)已完全,即
,证明这是弱酸,既然是弱酸,当它完全中和后生成的正盐溶液应呈弱碱性(强碱弱酸盐 水解,溶液呈弱碱性),所以,邻苯二甲酸和KOH溶液混合后,若pH=7,说明邻苯二甲酸和第 一步中和反应(生成KHC8H4O4)已完全,即 >1,但第 二步中和反应(KHC8H4O4
>1,但第 二步中和反应(KHC8H4O4 K2C8H4O4)尚不完全,即
K2C8H4O4)尚不完全,即 <2,现在酸和碱的体积相同,所以
<2,现在酸和碱的体积相同,所以 在1 -2之间,即2>x>1,答案为C。
在1 -2之间,即2>x>1,答案为C。
32.(1)2CaO2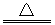 CaO+O2 (2)80.0% (3)
CaO+O2 (2)80.0% (3)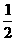
31.(1)M(OH)2+2NaHCO3=MCO3↓+Na2CO3+2H2O (2)②
(3)M的相对原子质量为137,NaHCO3的质量58.8 g
30.(1)1cm3中阴、阳离子总数=(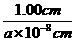 )3
)3
1cm3中Ni2+-O2-离子对数=(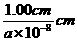 )3×
)3×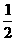
密度=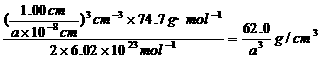
(2)解法Ⅰ:设1 mol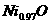 中含Ni3+x mol, Ni2+(0.97-x)mol。
中含Ni3+x mol, Ni2+(0.97-x)mol。
根据电中性 3x mol +2(0.97-x)mol=2×1 mol ∴x=0.06
Ni2+为(0.97-x)mol=0.91 mol
离子数之比 Ni3+:Ni2+=0.06∶0.91=6∶91
28.40.4% (12)n=1 29.(1)2,5
|
W、W(H2O) |
W、W(Cu) |
W、V(H2) |
W(H2O)、W(Cu) |
|
W(Cu)、V(H2) |
|
|
|
(2)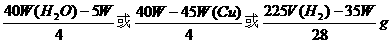
27.有关反应的化学方程式:Zn+FeCl2 Fe+ZnCl2
Fe+ZnCl2
Zn+CuCl2 Cu+ZnCl2
Cu+ZnCl2
(1)根据溶液Cl-的物质的量和反应前后固体的质量变化两关系可求得Fe2+和Cu2+的量。
设FeCl2 x mol,CuCl2y mol,则有
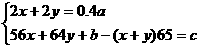
解得:x=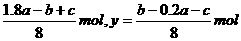 ,
,
则[Cu2+]= ,
,
[Fe2+]=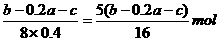 。
。
(2)由于x+y=0.2a mol,且b g Zn粉为过量,则b≥0.2a·65 g,即b≥13a g。
(3)在Cl-的总量一定的情况下,溶液中Cu2+和Fe2+总量也一定,消耗的Zn的总量也不变,所以滤液c的质量越大,则生成的Cu越多,原溶液中CuCl2的含量越大;当原溶液中只含CuCl2时,滤渣c的质量最大。
即Fe2+=0,有b-0.2a-c=0,c=b-0.2a。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com