
题目列表(包括答案和解析)
4.在周期表主族元素中,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断中,正确的是( )
A.原子半径:丙>乙>甲>丁
B.气态氢化物的稳定性:甲>丙
C.最高价氧化物对应水化物的酸性:丁>甲
D.乙和甲或乙和丁所能形成的化合物都是有毒物质
解析:由题意推知甲、丙同主族且丙在甲的下一周期,设其原子最外层电子数为x,乙、丁与甲在同一周期且左右相邻,乙、丁两原子最外层电子数之和为2x,则4x=20,即x=5,所以甲是N,丙是P,乙是O,丁是C。原子半径大小:丙>丁>甲>乙,故A错误;N比P的非金属性强,故NH3比PH3稳定,B正确;C比N的非金属性弱,最高价氧化物对应水化物的酸性H2CO3<HNO3,故C错误;乙和丁形成的化合物CO2是无毒物质,故D错误。
答案:B
3.(2009·广东单科,11)元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是( )
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
解析:分析题给条件可推知:X是钠(Na)、Y是氯(Cl)、Z是氧(O)。原子半径X>Y,但X+(Na+)与Z2-(O2-)电子层结构相同,离子半径X+>Z2-。
答案:B
2. (2009·山东理综,11)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
解析:Al元素既表现金属性又表现非金属性,故A项错误;氢元素失去1个电子为H+,最外层没有电子,得到1个电子为H-,为2电子稳定结构,故C项错误;ⅠA族中氢元素与钠元素最外层电子数相同,但化学性质不同。
答案:B
1.“神舟七号”的燃料是氢化锂三兄弟--LiH、LiD、LiT。其中Li的质量数为7,对这三种物质的下列说法正确的是( )
A.质子数之比为1∶2∶3 B.中子数之比为1∶1∶1
C.摩尔质量之比为8∶9∶10 D.化学性质不相同
解析:A项,质子数之比为(3+1)∶(3+1)∶(3+1)=1∶1∶1;B项,中子数之比为(4+0)∶(4+1)∶(4+2)=4∶5∶6;C项摩尔质量之比为:(7+1)∶(7+2)∶(7+3)=8∶9∶10;D项,三种物质的化学性质相同。
答案:C
4.A、B、C、D、E均为短周期主族元素。A元素原子的质子数等于其电子层数;B元素原子最外层电子数是次外层电子数的2倍;C元素是地壳中含量最多的元素;D为短周期中金属性最强的元素,E的最高价氧化物对应的水化物为最强酸。
(1)C、E两种元素分别是________、________;
(2)由A、B、C三种元素组成电子数为32的有机物X可能的分子式为__________(A、B、C用相应的元素符号表示);
(3)由A、B、C三种元素组成的一种物质Y,Y中三种原子个数之比为1∶1∶1,Y的相对分子质量小于110,Y的结构简式为_______________________________________________。
解析:根据已知条件可以确定A、B、C、D、E分别为氢、碳、氧、钠、氯五种元素,由C、H、O三种元素组成的有机物含有32个电子,设该有机物的分子式为CxHyOz,根据电子数等于32,可得6x+y+8z=32,讨论得出z=1,x=3,y=6,或z=2,x=2,y=4;或z=3,x=1,y=2(满足该条件的物质为碳酸,不合题意),X可能的分子式为C3H6O、C2H4O2。(3)M(CHO)n<110,只有n=2合理,Y的分子式为C2H2O2,其结构简式为OHC-CHO。
答案:(1)O Cl (2)C3H6O、C2H4O2 (3)OHC-CHO
3.由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种是离子,且每个微粒中都含有10个电子。已知A、B是由非金属元素组成的离子,六种微粒间有下列关系:
①A、B两种离子形成的一种化合物在加热条件下可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③含有E离子的化合物是淡黄色固体;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子的溶液,沉淀W却会溶解。
(1)写出A和含有E离子的淡黄色固体化合物的电子式________、________。
(2)A、B、C、D混合体系显________性,体系中存在的平衡有两个,其中使溶液呈此性的原理用电离方程式表示为:________________。
(3)请写出F离子与过量的C溶液反应的离子方程式:________________。写出F离子与过量的B离子反应的离子方程式________________。
(4)六种微粒中的两种可与硫酸根离子形成一种盐,向该盐的浓溶液中逐滴加入浓苛性钠溶液,产生的现象有:a.溶液中出现白色沉淀;b.有刺激性气味气体放出;c.沉淀逐渐增多;d.沉淀完全消失;e.沉淀逐渐减少。
①该复盐在溶液中的电离方程式是____________________________________________。
②上述各实验现象由先到后出现的正确顺序是________(填序号)。
解析:含10个电子的分子有CH4、NH3、H2O、HF等,离子有Na+、Mg2+、Al3+、O2-、F-、NH、NH、H3O+、OH-等。其中NH+OH-NH3·H2O,NH3·H2ONH3↑+H2O,NH3可使湿润的红色石蕊试纸变蓝;Al(OH)3是两性氢氧化物,既能溶于强酸,又能溶于强碱,过量的氨水与铝盐反应生成的是氢氧化铝;Al(OH)3与强碱反应生成四羟基合铝酸盐。(4)OH-与NH、Al3+都可以反应,但生成沉淀的反应比生成氨水的反应更容易,即OH-先与Al3+反应生成沉淀然后再与NH反应生成NH3·H2O,这两个反应完成后,继续加入强碱,生成的Al(OH)3沉淀又溶解。
答案:(1)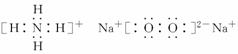 (2)碱 NH3·H2O
(2)碱 NH3·H2O NH+OH-
NH+OH-
(3)Al3++3NH3·H2O===Al(OH)3↓+3NH
Al3++4OH-===[Al(OH)4]-
(4)NH4Al(SO4)2===NH+Al3++2SO a、c、b、e、d
2. 2009年9月22日,化工易贸网讯 为维护社会秩序,保障公共安全,确保广州亚运会顺利进行,广州市人民政府决定对257种化学品实施管制。氮化钠(Na3N)就是其中的一种,它是科学家制备的一种重要的化合物,与水作用可产生NH3。

请根据材料完成下列问题:
(1)Na3N的电子式是______________,该化合物由______键形成。
(2)Na3N与盐酸反应生 成______种盐,其电子式分别为____________、____________。
(3)Na3N与水的反应属于________反应(填基本反应类型)。
(4)比较Na3N中两种粒子的半径:r(Na+)______r(N3-)(填“>”、“=”或“<”)。
解析:首先根据Na3N构成元素的活泼性确定其所属的化合物类型,Na3N与盐酸的反应可理解为Na3N与H2O反应所得的产物再与盐酸反应。

(1)钠位于第ⅠA族,是活泼金属,易失去一个电子形成Na+,N位于第ⅤA族,易得到3个电子,形成N3-,故Na+与N3-可形成离子化合物。
(2)Na3N与盐酸反应时,N3-与H+结合成NH3,NH3进一步与HCl反应生成NH4Cl、Na+与Cl-形成NaCl,故有2种盐生成。
(3)N3-与水反应属于复分解反应:Na3N+3H2O===3NaOH+NH3↑。
(4)Na+与N3-属于核外电子排布相同的粒子,钠的核电荷数大于氮的核电荷数,故
r(Na+)<r(N3-)。
答案:(1)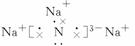 离子 (2)2
离子 (2)2 
(3)复分解 (4)<
1.如表所示是元素周期表(短周期)的一部分。A元素的原子中最外层电子数是其电子层数的两倍,且A处于元素周期表中主族的正中间。
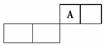
(1)在表中填写其他元素的符号,其中原子半径最大的是________(写名称)。
(2)A与表中同周期元素形成的化合物的化学式为________,A与其他三种元素形成的化合物中有两种能与水发生水解反应。请写出其中之一与水作用的化学方程式________________。
(3)表中某种元素的最高价氧化物对应的水化物与气态氢化物反应,生成物中存在的化学键有________。
(4)将表中四种元素分为两组,下列可以把两组内元素的金属性或非金属性都能加以比较的是( )
A.最高价氧化物对应水化物的酸碱性 B.单质与同浓度的酸反应放出氢气的快慢
C.相互之间发生的置换反应 D.单质与热水反应的剧烈程度
解析:将元素周期表知识融合在大题中进行考查也常在高考中出现,它基于考纲中要求掌握元素周期律的实质,了解元素周期表的结构及其应用这一考点。本题实际上是一道推断题,也从侧面考查了元素位、构、性三者之间的关系。首先根据A元素原子的核外电子排布特点确定A是C,则其他三种元素是Mg、Al和N,C和这三种元素形成的常见化合物有C3N4、Al4C3及MgC2,其中后两种物质在水中很容易发生水解反应。表中元素的最高价氧化物对应的水化物与气态氢化物能发生反应的只有N,产物是NH4NO3,存在的化学键有离子键和共价键。在备考复习过程中同学们应注意以下“三角”递变关系:(1)若A、B、C三种元素位于元素周期表中如图所示位置,则有关的各种性质均可排出顺序(但D不能参与排列)。如:①原子半径:C>A>B;②金属性:C>A>B;③非金属性:B>A>C。(2)元素周期表中的相似规律:①同主族元素性质相似(因为最外层电子数均相同);②元素周期表中位于对角线位置(图中A、D相对位置)的元素性质相似,如Li和Mg、Be与Al、B和Si等;③相邻元素性质差别不大。
答案:(1)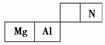 镁 (2)C3N4 Al4C3+12H2O===4Al(OH)3↓+3CH4↑(或其他合理答案) (3)离子键、共价键 (4)A
镁 (2)C3N4 Al4C3+12H2O===4Al(OH)3↓+3CH4↑(或其他合理答案) (3)离子键、共价键 (4)A
5.(4)(i)0.035 mol (ii)5 g
23. (2009·上海单科,31)烟气中NOx是NO和NO2的混合物(不含N2O4)。
(1)根据废气排放标准,1 m3烟气最高允许含400 mg NOx。若NOx中NO质量分数为0.85,则1 m3烟气中最高允许含NO________L(标准状况,保留2位小数)。
(2)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度1.16 g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为________mol/L(保留2位小数)。
(3)已知:NO+NO2+Na2CO3===2NaNO2+CO2①
2NO2+Na2CO3===NaNO2+NaNO3+CO2②
1 m3含2 000 mg NOx的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气________排放标准(填“符合”或“不符合”),理由:________________________________________________________________________。
(4)加入硝酸可改变烟气中NO和NO2的比,反应为:NO+2HNO3===3NO2+H2O
当烟气中n(NO)∶n(NO2)=2∶3时,吸收率最高。
1 m3烟气含2 000 mg NOx,其中n(NO)∶n(NO2)=9∶1。
计算:(i)为了达到最高吸收率,1 m3烟气需用硝酸的物质的量(保留3位小数)________。
(ii)1 m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应后,反应①比反应②迅速。计算结果保留1位小数)________。
解析:(1)×22.4 L/mol=0.25 L。
(2)c(Na2CO3)===1.64 mol·L-1。
(4)(i)30n(NO)+×46n(NO)=2 g
n(NO)=0.057 mol
NO+2HNO3===3NO2+H2O
x 2x 3x
= x=0.017 6 mol
n(HNO3)=2x=0.035 mol。
(ii)加入HNO3使NO与NO2物质的量之比达到2∶3时NO2的实际物质的量已经变为:×0.057+3x=0.059 mol,NO的实际物质的量已经变为:0.057-x=0.039 mol。
根据题(3)中①②两个方程式可以得出:
n(NaNO2)=2n(NO)+[n(NO2)-n(NO)]=0.088 7 mol
m(NaNO2)=0.088 7×69×90%=5.5 g。
答案:(1)0.25 (2)1.64
(3)不符合 因吸收后烟气总体积减小,NOx含量仍超过400 mg/m3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com