
题目列表(包括答案和解析)
4. 下列有关化学反应速率的说法中,正确的是( )
A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C.二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
解析:选项A中,加入氯化钠溶液,因氯化钠溶液中有溶剂水,则它的加入相当于对盐酸稀释,浓度降低,反应速率减慢;选项B中,改用铁片与浓硫酸反应时,如常温则发生钝化,如加热,则反应生成二氧化硫气体,得不到氢气;选项C中,不论该化学反应是放热反应还是吸热反应,升温,化学反应速率必然加快;D项对有气体参与的反应,减小压强,气体的浓度降低,反应速率减慢。
答案:D
3. 把下列4种X溶液,分别加入到4个盛有10 mL 2 mol/L盐酸的烧杯中,并加水稀释到50 mL,此时X与盐酸缓缓地进行反应,其中反应速率最大的是( )
A.20 mL,3 mol/L B.20 mL,2 mol/L C.10 mL,4 mol/L D.10 mL,2 mol/L
解析:此题主要考虑浓度对化学反应速率的影响,X溶液的浓度大小决定了反应速率的快慢。那么是否是C中4 mol/L的X与盐酸反应速率最快呢?此题很容易错选C答案,实际上应考虑加水稀释后X溶液的浓度,同一体积的溶液中X的物质的量越大,浓度就越大,A中X的物质的量最大,故速率最大。
答案:A
2.反应A(g)+3B(g) 2C(g);ΔH<0,达到平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
2C(g);ΔH<0,达到平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
A.正反应速率加大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率增大,平衡向逆反应方向移动
C.正反应速率和逆反应速率减小,平衡向正反应方向移动
D.正反应速率和逆反应速率减小,平衡向逆反应方向移动
解析:题目提供的是一个正反应方向放热的化学反应,所以降低温度,平衡向正反应方向移动;而温度对化学反应速率的影响是不分正反应和逆反应的,即温度降低,正、逆反应速率都减小。
答案:C
1.氨分解反应在容积为2 L的密闭容器内进行。已知起始时氨气的物质的量为4 mol,5秒末为2.4 mol,则用氨气表示该反应的速率为( )
A.0.32 mol/(L·s) B.0.16 mol/(L·s) C.1.6 mol/(L·s) D.0.8 mol/(L·s)
解析:化学反应速率是用单位时间内某物质浓度的变化来表示,其中“单位时间”和“物质浓度的变化”两个因素必须同时考虑,缺一不可。若忽略了“单位时间”只考虑氨气的物质的量的变化,会误选C;只考虑氨气的浓度的变化,会误选D;若将反应速率误认为是以单位时间内物质的物质的量变化来表示,会误选A。正确的计算是:v(NH3)==0.16 mol/(L·s)
答案:B
16.在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后`溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是__________(填粒子
的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物质是
________。
(2)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及
实验中观察到的现象。
|
____同学正确 |
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是
______________。若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为
是否可行?________,理由是___________________________________________
________________________________________________________________________。
解析:溴能够溶解于有机溶剂中,而Fe3+可以用KSCN溶液检验。
答案:(1)Br2 Fe3+
(2)如下表:
|
乙同学正确 |
选用试剂 |
实验现象 |
|
第一种方法 |
C |
有机层无色 |
|
第二种方法 |
D |
溶液变红色 |
(3)Fe2+ 不可以 因为Br2和Fe3+都能把I-氧化成I2
15.(2010·改编)现有浓度分别为1 mol/L的FeCl3、FeCl2、CuCl2混合溶液100 mL,加入一定量的铁粉,按下列情况填空。
(1)充分反应后,如果溶液中还有一定量的Cu2+,则溶液中一定含有的金属离子还有
________,该离子在溶液中的物质的量范围为________,可能含有的金属或金属离
子为________。
(2)反应完毕后,铁粉有剩余,溶液中一定含有的金属离子为________,为
________mol,一定没有的金属离子为________。
解析:该题涉及的反应有:
①Fe+2FeCl3===3FeCl2 ②Fe+CuCl2===Cu+FeCl2 ③Cu+2FeCl3===2FeCl2+
CuCl2
(1)当Cu2+有剩余时,一定无铁粉,一定有Fe2+;
若Fe3+剩余,则容器中含有Fe3+、Fe2+、Cu2+;
若Fe3+恰好反应,则容器中含有Fe2+、Cu2+;
若Cu2+部分反应,则容器中含有Cu、Fe2+、Cu2+。
当Fe3+未被还原时,Fe2+取最小值为0.1 mol,
当Cu2+全部被还原时,Fe2+取最大值为0.35 mol。
(2)若Fe粉有剩余,则溶液中就不可能有Fe3+、Cu2+,因为它们能发生上述①②
反应。
反应完毕后,溶液中一定含有Fe2+,由反应的化学方程式可知n(Fe2+)=n(FeCl3)
+n(CuCl2)+n(FeCl2)=×0.1 mol+0.1 mol+0.1 mol=0.35 mol
答案:(1)Fe2+ 0.1 mol<n(Fe2+)<0.35 mol Cu或Fe3+ (2)Fe2+ 0.35 Fe3+、Cu2+
14.如图所示,此装置可用来制取和观察Fe(OH)2在空
气中被氧化时的颜色变化,实验时必须使用铁屑和
6 mol/L的硫酸,其他试剂任选。填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入试剂是________。A中反应的
离子方程式是________________________________________________。
(2)实验开始时应先将活塞a________(填“打开”、“关闭”)。
(3)简述生成Fe(OH)2的操作过程
____________________________________________________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为
____________________________________________________________________
____________________________________________________________________。
(5)下列各图示中________能较长时间看到Fe(OH)2白色沉淀。
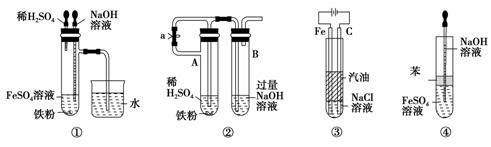
解析:制备Fe(OH)2并观察Fe(OH)2在空气中的颜色变化,关键是在无氧环境中制
得Fe(OH)2。本实验中先用H2排出装置内的空气,故实验开始时应先打开活塞a,
让生成的H2排尽装置的空气,然后关闭活塞a,通过烧瓶中气体压强将FeSO4溶液
压入锥形瓶中,即可制得Fe(OH)2,最后打开活塞b,放入空气,即可观察Fe(OH)2
的变色情况。对于(5)各装置均能让Fe2+与OH-在无氧条件下反应,均可长时间观察
Fe(OH)2的颜色。
答案:(1)铁屑 Fe+2H+===Fe2++H2↑ (2)打开 (3)关闭活塞a,使FeSO4溶液被
压入B中进行反应 (4)4Fe(OH)2+2H2O+O2===4Fe(OH)3 (5)①②③④
0.28 g m(H2)
m(H2)==0.013 3 g,V(H2)==0.152 L
故V(H2)=152 mL,应选择200 mL的量筒,若选用500 mL或1 000 mL的量筒,误差太大。若生成氢气体积为V L,则m(H2)=0.088 V g,消耗铁的质量:m(Fe)=
=1.848 V g
铁的转化率为:×100%=6.6 V×100%。
 答案:(1)肥皂泡破裂,有爆鸣声 3Fe+4H2O(g)Fe3O4+4H2 (2)①B ②B ③6.6 V×100%
答案:(1)肥皂泡破裂,有爆鸣声 3Fe+4H2O(g)Fe3O4+4H2 (2)①B ②B ③6.6 V×100%
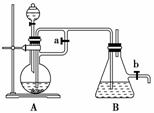
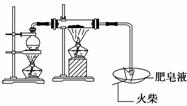
13.(2010·青岛模拟)某研究小组为了探究“铁与水
蒸气”能否发生反应及反应的产物,进行了下
列实验。
(1)用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,
并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材
料,不与水反应)。
反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当________时(填实
验现象),说明“铁与水蒸气”能够进行反应。写出铁与水蒸气反应的化学方程式
________________________________________________________________________。
(2)为了研究一定时间内铁粉的转化率,他们设计了如下实验:准确称量一定质量的
铁粉进行反应,收集并测量反应后生成气体的体积,计算出铁粉的转化率。
①收集并测量气体体积应选图中的________装置。
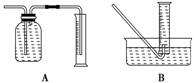
②称取0.28 g铁粉与适量石棉绒混合,然后加热至无气体放出。若室温下氢气密度
约为0.088 g/L,最好选用________规格的量筒(选填字母序号)。
A.100 ml B.200 mL C.500 mL D.1 000 mL
③收集的气体体积为V L,则铁粉的转化率为________。
解析:(1)利用氢气的可燃性可证明铁与水蒸气能反应且产物为氢气。
(2)利用排水法收集并测定H2的体积,A装置,广口瓶中进气管长,出气管短,不能
排出广口瓶中的水,也不能测量H2的体积。根据反应方程式:计算可解决②③,若
铁完全反应,则:
3Fe + 4H2O(g)Fe3O4+4H2
168 g 8 g
12.(2008·宁夏理综,26)某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
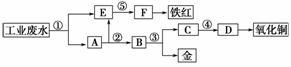
填写下面空白:
(1)图中标号处需加入的相应物质分别是
①________、②________、③________、④________、⑤________。
(2)写出①处发生反应的离子方程式
_______________________________________________________________________
_______________________________________________________________________;
写出③处发生反应的化学方程式
_______________________________________________________________________
______________________________________________________________________。
(3)铁红的化学式为________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红________________________________________________________________;
氧化铜____________________________________________________________。
解析:(1)本实验的目的是用废铁屑、常用的酸和碱,从废水中回收金,并生产一定
量的铁红和氧化铜。而废水中含有Fe3+、Cu2+、Au3+,因此首先加入废铁屑将Cu
和Au都置换出来。Cu和Au的分离可以利用Cu与稀硝酸能反应而Au不能,将其
分离,Cu2+和Fe2+分别加入碱使其转化为沉淀,灼烧分别生成它们的氧化物。
(2)由于废水显酸性,又含有Cu2+、Au3+、Fe3+,因此加入铁屑发生反应的离子方程
式为:Fe+2H+===H2↑+Fe2+ Fe+Cu2+===Cu+Fe2+
3Fe+2Au3+===2Au+3Fe2+ 2Fe3++Fe===3Fe2+
(3)铁红的化学式为Fe2O3,铁红常用作红色颜料,氧化铜常用作制铜盐的原料。
答案:(1)①铁屑 ②稀硫酸 ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠
(2)Fe+2H+===Fe2++H2↑,2Fe3++Fe===3Fe2+,
Cu2++Fe===Cu+Fe2+,2Au3++3Fe===2Au+3Fe2+
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
 (3)Fe2O3 用作红色颜料 用作制造铜盐的原料
(3)Fe2O3 用作红色颜料 用作制造铜盐的原料
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com