
题目列表(包括答案和解析)
反应A+3B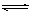 2C+2D在四种不同情况下的反应速率分别为:
2C+2D在四种不同情况下的反应速率分别为:
①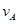 =0.15mol/(L·min) ②
=0.15mol/(L·min) ②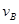 =0.01mol/(L·s)
=0.01mol/(L·s)
③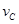 =0.40mol/(L·min)
④
=0.40mol/(L·min)
④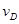 =0.45mol/(L·min),
=0.45mol/(L·min),
该反应进行的快慢顺序为(填序号) 。
在溶液中,反应A+2BC分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol·L-1,c(B)=0.200 mol·L-1,c(C)=0 mol·L-1。反应物A的浓度随时间的变化如图所示。下列说法正确的是
A.若反应①、②的平衡常数分别为K1、K2,则K1< K2
B.反应A+2BC的△H>0
C.实验②平衡时B的转化率为60%
D.减小反应③的压强,可以使平衡时c(A)=0.060 mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com