
题目列表(包括答案和解析)
4.如下图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加其他任何物质,发现(1)中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )
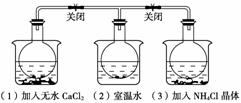
A.CaCl2溶于水时放出热量
B.烧瓶(1)中气体的压强不变
C.NH4Cl溶于水时放出热量
D.烧瓶(3)中气体的压强增大
解析:三个烧瓶中都存在如下平衡:2NO2(g)  N2O4(g);ΔH<0,(1)中红棕色变深,平衡左移,所以CaCl2溶于水放热,(3)中变浅,平衡右移,说明NH4Cl溶于水时吸热
N2O4(g);ΔH<0,(1)中红棕色变深,平衡左移,所以CaCl2溶于水放热,(3)中变浅,平衡右移,说明NH4Cl溶于水时吸热
答案:A
3.一定条件下,在可变容积的密闭容器中进行下列可逆反应:
S2Cl2(l)+Cl2(g)  2SCl2(l);ΔH=-51.16
kJ·mol-1
2SCl2(l);ΔH=-51.16
kJ·mol-1
浅黄色 鲜红色
下列说法正确的是( )
A.达到平衡时,抽出少量氯气,反应混合液颜色变深
B.单位时间内生成2n mol S2Cl2,同时生成n mol SCl2时,平衡向逆反应方向移动
C.达平衡时,降低温度,混合液的颜色将变浅
D.单位时间内有n mol Cl2被还原,同时氧化生成n mol Cl2时,平衡向正反应方向移动
解析:抽出Cl2,平衡不移动,混合液颜色不变,A项错误;B项正确;降温,平衡正移,混合液颜色变深,C项错误;n mol Cl2被还原,同时n mol Cl2被氧化,即v正=v逆,平衡不移动,故D项错误。
答案:B
2.
(2008·全国理综 Ⅰ,11)已知:4NH3(g)+5O2(g)  4NO(g)+6H2O(g);ΔH=-1
025 kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
4NO(g)+6H2O(g);ΔH=-1
025 kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
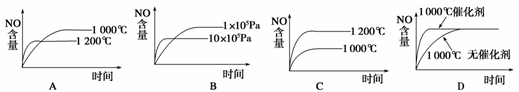
解析:由于该反应为放热反应,升高温度平衡左移,NO的含量降低,因此A正确、C错;又由于该反应为气体体积增大的反应,增大压强平衡左移,因此压强越大,NO的含量越低,故B正确;而催化剂只能提高反应速率,不会引起平衡的移动,因此D正确。
答案:C
1.已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是( )
①生成物的质量分数一定增加 ②生成物产量一定增加 ③反应物的转化率一定增大 ④反应物的浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥一定使用催化剂A.①②③ B.③④⑤ C.②⑤ D.④⑥
解析:当增加某反应物的浓度平衡正向移动,生成物的质量分数可能减小,该反应物的浓度增大;当多种物质作反应物时增加一种反应物浓度,平衡正向移动,该反应物的转化率降低,其余反应物的转化率增大;使用催化剂不改变化学平衡移动的方向。
答案:C
11.反应2A(g)+B(g)  3C(g),起始时按5∶2的体积比将A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使其反应,达到平衡时混合气体中C的体积分数为60%。
3C(g),起始时按5∶2的体积比将A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使其反应,达到平衡时混合气体中C的体积分数为60%。
求:(1)A、B的转化率分别为:αA=________,αB=________。
(2)平衡混合气体的平均相对分子质量(设A的相对分子质量为MA,B的相对分子质量为MB):__________。
(3)平衡时压强与起始相比,有何变化?________(填“增大”“不变”或“减小”)。
解析:(1)2A(g)+B(g)  3C(g)
3C(g)
起始量 5 2 0
变化量 2x x 3x
平衡量 5-2x 2-x 3x
由已知得×100%=60% x=1.4,所以αA=×100%=56%
αB=×100%=70%。
(2)总质量、总体积保持不变,则恒温下,平衡后的混合气体平均相对分子质量即为A、B两气体混合时的平均相对分子质量。
(3)反应2A(g)+B(g)3C(g)中两边气体总系数相等,反应前后气体的总的物质的量不变,则在恒温恒容条件下,压强不变。
答案:(1)56% 70% (2)= (3)不变
10.将各2a mol的P、Q、R、S在一密闭容器中混合,发生如下反应:xP+yQ zR+wS。达到平衡后,测得n(P)=a
mol,n(Q)=
mol,n(R)=
mol,n(S)=3a
mol,已知四种物质中只有R是固体。
zR+wS。达到平衡后,测得n(P)=a
mol,n(Q)=
mol,n(R)=
mol,n(S)=3a
mol,已知四种物质中只有R是固体。
(1)若该反应中物质的化学计量数x=2,则z=________,w=________。
(2)达到平衡时,P的转化率是____________。
(3)如果只改变压强,化学反应速率发生变化,但化学平衡不移动。则该反应中各物质的聚集状态分别是:Q____________,S____________。
(4)如果只升高温度,反应一段时间后,各物质的物质的量均变为2a mol,则该反应的正反应为________热反应。
解析:(1)xP+yQ zR + wS
zR + wS
始/mol: 2a 2a 2a 2a
平/mol: a a a 3a
变/mol: a a a
x∶y∶z∶w=a∶∶a∶a=2∶1∶3∶2,由x=2得z=3,w=2。
(2)P的转化率为×100%=50%。
(3)若改变压强,化学反应速率发生变化,但化学平衡不移动,则该反应为气体体积不变的反应。Q为液态(因已知只有R为固态,故Q不能为固态),S为气态。
(4)由题设条件可推知,升温平衡向逆反应方向移动,因此正反应为放热反应。
答案:(1)3 2 (2)50% (3)液态 气态 (4)放
9.(2008·海南,15)反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如下图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如下图所示,回答下列问题。
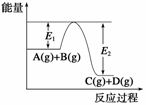
(1)该反应是________反应(填“吸热”或“放热”);
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”“减小”或“不变”),原因是________________________________________________________。
(3)反应体系中加入催化剂对反应热是否有影响?________________________________________________________________________,
原因是______________________________________________________;
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2__________(填“增大”“减小”或“不变”)。
解析:(1)从图像上可以看出,反应物的总能量比生成物的总能量高,因此该反应为放热反应。
(2)升高温度,平衡左移,因此A的转化率减小。
(3)加入催化剂,对反应热无影响,因为催化剂不改变反应进行的程度,反应物参加反应的量不变,所以反应热也不变。
(4)催化剂改变了反应的历程,降低了反应所需要的活化能,使E1减小,E2也减小。
答案:(1)放热 (2)减小 根据勒夏特列原理,升高温度反应向吸热方向移动,因而该反应中A的转化率减小 (3)没有 催化剂只能改变化学反应的速率和途径,不能改变化学反应始态和终态的能量,因此对反应热没有影响 (4)减小 减小
8. 在一定条件下,xA+yB zC的可逆反应达到平衡:
zC的可逆反应达到平衡:
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z的关系是:____________。
(2)已知C是气体,且x+y=z,在加压时,如果平衡发生移动,则平衡必向________方向移动。
(3)已知B、C是气体,现增加A物质的量(其他条件不变),平衡不移动,则A是______态。
(4)加热后C的质量分数减少,则正反应是________热反应。
解析:(1)减压平衡向化学计量数增大的方向移动,则x+y>z。
(2) 如果都是气体,则平衡不移动;如果A、B至少一种为非气体,则平衡向逆反应方向移动。
(3)A是非气态物质,如液态或固态。
(4)加热平衡向吸热方向移动,则逆反应是吸热反应,正反应是放热反应。
答案:(1)x+y>z (2)逆反应 (3)固或液 (4)放
7.(2009·广东单科,7,有改动)难挥发性二硫化钽(TaS2)可采用如下图所示装置提纯。将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
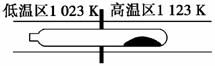
TaS2(s)+2I2(g)  TaI4(g)+S2(g)
TaI4(g)+S2(g)
下列说法正确的是( )
A.在不同温度区域,TaI4的量保持不变
B.在提纯过程中,I2的量不断减少
C.在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
D.该反应的平衡常数与TaI4和S2的浓度乘积成反比
解析:A项,TaI4主要存在于高温区;B项,在提纯过程中,I2的量应基本保持不变;D项,该反应的平衡常数为:K=。
答案:C
6. 在一定条件下,合成氨反应达到平衡后,混合气体中氨的体积分数为25%,若反应前后条件不变,则反应后缩小的体积与原反应物体积的比值为( )
A.1/5 B.1/4 C.1/3 D.1/2
解析:由合成氨的反应N2(g)+3H2(g)  2NH3可知:反应过程中缩小的体积等于生成的氨的体积,若设反应前气体的总体积为V,达到平衡后有x体积的N2转化,则生成氨的体积为2x,气体的总体积为V-2x,据题意知:×100%=25%,解得:=。
2NH3可知:反应过程中缩小的体积等于生成的氨的体积,若设反应前气体的总体积为V,达到平衡后有x体积的N2转化,则生成氨的体积为2x,气体的总体积为V-2x,据题意知:×100%=25%,解得:=。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com