
题目列表(包括答案和解析)
6、误差分析(重点与难点)
例如,用已知浓度的盐酸滴定未知浓度的NaOH溶液。
c酸V酸==c碱V碱
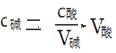
式中:c酸为标准溶液的准确浓度(不变量),V碱为待测液的体积(不变量)。
显然,影响NaOH溶液浓度的因素是标准溶液的体积读数,若消耗标准溶液比理论值多,则测定结果偏高;若消耗标准溶液比理论值少,则测定结果偏低。简化为“多则高,少则低”。
中和滴定过程中,容易产生误差的6个方面是:
⑴洗涤仪器:(滴定管、移液管、锥形瓶);
⑵气泡;
⑶体积读数(仰视、俯视);
⑷指示剂选择不当;
⑸杂质的影响;
⑹操作(如用力过猛引起待测液外贱等)。
具体分析如下:
⑴滴定前,在用蒸馏水洗涤滴定管后,未用HCl标准溶液润洗酸式滴定管就装液进行滴定。
⑵滴定前,有气泡,滴定后气泡消失。
⑶滴定前,用待测液润洗锥形瓶。
⑷取待测液时,移液管用蒸馏水洗涤后,未用待测液润洗。
⑸取液时,移液管尖端的残留液吹入锥形瓶中。
⑹读取标准液的刻度时,滴定管开始前平视读数,滴定终了时俯视读数。
⑺若用甲基橙作指示剂,最后一滴盐酸滴入使溶液由橙色变为红色。
⑻滴定过程中,锥形瓶振荡太剧烈,有少量溶液溅出。
⑼滴定后,滴定管尖端挂有液滴未滴入锥形瓶中。
⑽滴定管开始前仰视读数,滴定终了时俯视读数。
⑾滴定过程中,向锥形瓶中加入少量蒸馏水。
⑿滴定过程中,滴定管漏液。
⒀滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准溶液至锥形瓶中。
⒁过早估计滴定终点。
⒂过晚估计滴定终点。
⒃一滴标准溶液附在锥形瓶壁上未洗下。
⑴偏高⑵偏高⑶偏高⑷偏低⑸偏高⑹偏低⑺偏高⑻偏低⑼偏高⑽偏低⑾无影响⑿偏高
⒀操作正常,无影响⒁偏低⒂偏高⒃偏高
专题训练
5、读数与记录
滴定管的“0”刻度在上端(与量筒相反),读书时,视线平视,不能仰视或俯视。记录数据要与实验条件的精确度一致(如12.5mL).要求把同一样品滴定两次,取两次测定数据的平均值计算结果。
4、中和滴定的操作
左手控制滴定管,右手摇动锥形瓶,向同一方向作圆周运动,眼睛注视锥形瓶内溶液颜色的变化。临近终点时滴液要慢,至指示剂变色且半分钟内不褪色或不变为原色即为终点,避免过量(如果过量,应进行回滴,并记录滴入的体积)。整个操作要领可总结为
“四先四后”:
⑴先把滴定管洗净,后检查滴定管是否漏水,活塞旋转是否灵活;
⑵滴定管、移液管先用水洗净,后用待装液润洗2-3次;
⑶取液时,一般是先将标准液注入滴定管,后将待测液放入锥形瓶;
⑷滴定的速率一般是先快后慢。
3、仪器的使用要求
滴定管:使用前检查是否漏水,除去尖嘴部分的气泡,并调整液面至“0”刻度或“0”刻度以下。
移液管:放完待测液后,不能把移液管尖端的残留液吹入锥形瓶中,因为在制作移液管时已考虑到在移液管尖端的残留液不包括在应有的体积数之内。
待测液的量取:既可用移液管,也可用滴定管注入锥形瓶内。
标准液的量取:只能用滴定管不能用移液管。
2、仪器的洗涤
玻璃仪器洗净的标准是:仪器内水均匀分布,不成股流下。
滴定管、移液管:先用水洗净,再用待装液润洗2-3次。对滴定管使用时要检查是否漏水。
锥形瓶:只能用蒸馏水洗净,不能用待测液润洗。
为提高酸碱中和滴定测定结果的准确性,必须准确测定参加反应的两种溶液的体积,并准确判断中和反应是否恰好进行完全。具体应从以下几个方面突破。
1、指示剂的选择
滴定时选用的指示剂一般有酚酞和甲基橙,石蕊试液由于变色不明显,在滴定时不宜使用。
选择原则:指示剂的颜色变化灵敏,变色范围最好接近等当点(化学计量点)。
常用选择:
|
滴定类别 |
选择的指示剂 |
选择理由 |
|
强碱滴定强酸 |
酚酞 |
在滴定终点时浅色变成深色更易于观察 |
|
强酸滴定强碱 |
甲基橙 |
在滴定终点时浅色变成深色更易于观察 |
|
强酸滴定弱碱 |
甲基橙 |
生成的盐水解呈酸性,甲基橙的变色范围为3.1-4.4,落在酸性范围之内。 |
|
强碱滴定弱酸 |
酚酞 |
生成的盐水解呈碱性,酚酞的变色范围为8-10,落在碱性范围之内。 |
需要指出的是滴定所用的指示剂的用量一般为2滴,不能太多或太少。因为酸碱指示剂属于有机酸或有机碱,指示剂也参加反应,在变色过程中消耗标准溶液。若指示剂用量太多,则消耗掉的标准溶液也有所增多,会导致误差;若指示剂用量太少,其颜色变化不明显,致使终点提前或延迟,使实验误差增大。
2、
酸与碱混合发生中和反应的实质是酸电离出的H+与碱电离出的OH-结合成水,那么,中和反应的离子方程式都可用“H++OH- H2O”
表示吗?当然不是的,反应物中一旦出现弱酸或弱碱,在离子方程式中都要用分子式表示;就是强酸与强碱反应,离子方程式也不一定能“H++OH- H2O”
表示,如硫 酸与强氧化钡溶液的反应应写为:
Ba2++2OH-+2H++SO42- BaSO4↓+2H2O。反过来,能用
“H++OH- H2O”
表示离子方程式的反应,一定是酸与碱发生的中和反应吗?答案也是否定的,如NaOH溶液与NaHSO4溶液的反应离子方程式
可用“H++OH- H2O”
表示,但它属于盐与碱液的反应。
1、提到酸与碱的反应,人们自然就会想到中和反应,那么,酸与碱混合一定发生中和反 应吗?答案是否定的。酸与碱混合不一定发中和反应包含两层含义:一是酸与碱混合不一定发生中和反应,如:将硅酸与氢氧化镁等难溶性碱混合就不一定发生反应;二是酸与碱混合发生反应不一定是中和反应,如:
3Fe(OH)2+10HNO3 3Fe(NO3)3 +NO↑ +8H2O
2Fe(OH)3 +6HI
2FeI2 +I2 + 6H2O
18、3-甲基香豆素有香草味,可用于香料及化妆品,其结构简式为 。关于它的说法正确的是( )
。关于它的说法正确的是( )
A.分子式为C10H10O2
B.分子中所有原子可能在同一平面上
C.1 mol该有机物与Br2的CCl4溶液发生加成反应,可以消耗5 mol Br2
D.1 mol该有机物与NaOH溶液反应,可以消耗2 mol NaOH

17、1mol某有机物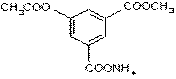 与足量NaOH溶液充分反应,消耗NaOH的物质的量是( )
与足量NaOH溶液充分反应,消耗NaOH的物质的量是( )
A.2mol B.3mol C.4mol D.5mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com