
题目列表(包括答案和解析)
11.X、Y为同周期元素,如果X的原子半径大于Y,则下列判断不正确的是( )
A.若X、Y均为金属元素,则X的金属性强于Y
B.若X、Y均为金属元素,则X的阳离子氧化性比Y的阳离子氧化性强
C.若X、Y均为非金属元素,则Y的气态氢化物比X的稳定
D.若X、Y均为非金属元素,则最高价含氧酸的酸性Y强于X
解析:X、Y是同周期元素,X的半径大于Y,则X的原子序数小于Y。若X、Y均为金属元素,同周期从左到右,元素的金属性从强到弱,离子的氧化性从弱到强,故A项正确,B项不正确;若X、Y均为非金属元素,从左到右,元素的非金属性从弱到强,气态氢化物越来越稳定,最高价氧化物对应的水化物酸性越来越强,故C、D项正确。
答案:B
10.a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物对应水化物呈碱性,且碱性b>a;c和d的气态氢化物的还原性d>c;五种元素的原子得失电子后所形成的简单离子中e的离子半径最小,则它们的原子序数由小到大的顺序是( )
A.b、a、d、c、e B.e、b、a、d、c C.b、a、e、d、c D.c、d、e、a、b
解析:a和b的最高价氧化物对应水化物呈碱性,则a、b为金属,且失电子能力b>a(其最高价氧化物对应水化物的碱性b>a);c和d的气态氢化物的还原性d>c,即c、d为非金属,且得电子能力d<c。根据同周期元素从左到右失电子能力逐渐减弱,得电子能力逐渐增强的规律,将a、b、c、d四种元素大致排序为: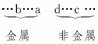 因为五种元素的原子得失电子后所形成的简单离子中e的离子半径最小,则e应为金属元素,且原子序数b<a<e(如Na、Mg、Al)。
因为五种元素的原子得失电子后所形成的简单离子中e的离子半径最小,则e应为金属元素,且原子序数b<a<e(如Na、Mg、Al)。
答案:C
9.国际无机化学命名委员会将长式元素周期表原先的主、副族号取消,从左往右改为18列,碱金属为第1列,稀有气体为18列。按这个规定,下列说法不正确的是( )
A.只有第2列元素的原子最外层有2个电子
B.第14列元素形成的化合物种类最多
C.第3列元素种类最多
D.第16、17列元素都是非金属元素
解析:在长式周期表中各族元素的排列顺序为:ⅠA、ⅡA、ⅢB―→ⅦB、Ⅷ、ⅠB、ⅡB、ⅢA―→ⅦA、0族,18列元素应分别与以上各族对应。所以第2列为碱土金属族,其最外层有2个电子,但元素He及多数过渡元素的最外层也是2个电子;第14列为碳族元素,形成化合物的种类最多;第3列为ⅢB族,有镧系和锕系元素,元素种类最多;第16、17列分别为氧族和卤族元素,并非全部为非金属元素。
答案:AD
8.短周期元素中,若两种元素的原子序数相差8,则它们( )
A.一定是同族元素 B.周期数一定相差1
C.只能形成1∶1型化合物 D.只能形成1∶2型化合物
解析:原子序数相差8的短周期元素可能在同一主族如氧和硫,也可能不在同一主族,如H和F;在短周期元素中列举符合条件的化合物可有HF、SO2、SO3、SiC等。
答案:B
7. 下列事实一般不能用于判断金属性强弱的是( )
A.金属间发生的置换反应
B.1 mol金属单质在反应中失去电子的多少
C.金属元素的最高价氧化物对应的水化物的碱性强弱
D.金属元素的单质与水或酸反应置换出氢气的难易程度
解析:元素的金属性是指元素的原子失电子的能力,元素的原子失电子的能力越强,元素的金属性就越强;金属活泼性是指单质在水溶液中失电子的能力,失电子的能力越强,金属活泼性越强;所以A、C、D都可以用于判断金属性强弱;而1 mol金属单质失电子的多少由原子结构决定,与失电子能力强弱无关。
答案:B
6.下列说法正确的是( )
A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
解析:同周期第ⅠA族元素金属性比第ⅡA族元素强,但不同周期比较,如Na(ⅠA)、Ca(ⅡA),前者金属性较弱;第ⅥA族元素的氢化物中稳定性最好的是H2O,因分子间存在氢键,其沸点也最高;同周期非金属元素最高价氧化物的水化物酸性从左到右依次增强,但低价态氧化物的水化物酸性不一定如此,如H2SO4的酸性比HClO强;第三周期元素离子半径大小顺序为:P3->S2->Cl->Na+>Mg2+>Al3+。
答案:B
5.下列关于非金属元素气态氢化物的叙述正确的是( )
A.气态氢化物的水溶液都是酸 B.气态氢化物都可由非金属单质和H2直接化合
C.气态氢化物是极性分子 D.气态氢化物都是共价化合物
解析:此题可以用反例法选择。NH3水溶液显碱性;碲、砹等非金属不能直接与氢气化合;CH4为非极性分子。
答案:D
4.有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是( )
A.HF B.NH4Cl C.NaH D.H2O2
解析:ⅦA族元素原子在反应中易获得一个电子,显-1价,如NaH,C项中氢元素显-1价符合题意,A、B、D三项中氢元素均显+1价,不能支持这种观点。
答案:C
3. 已知原子序数,可以推断原子的( )
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数 ⑥原子结构示意图 ⑦元素在周期表中的位置
A.①②③④⑥ B.①④⑤⑥⑦
C.②③④⑤⑦ D.③④⑤⑥⑦
解析:由原子序数定义可直接得出①④⑤;由⑤和核外电子排布规律可推⑥,如:31号元素原子结构示意图为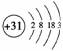 ;由⑥可推⑦,如:31号元素位于第四周期ⅢA族。
;由⑥可推⑦,如:31号元素位于第四周期ⅢA族。
答案:B
2. X、Y是元素周期表中ⅦA族中的两种元素,下列叙述中能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
解析:本题是ⅦA族元素非金属性的比较,因此必须与本族元素的特性联合考虑。A选项中X原子电子层数多于Y,因此在同族中X在Y的下方,根据同主族元素由上向下,非金属性减弱可知,X的非金属性比Y弱,故A错误;B是氢化物的沸点问题,Y的氢化物如果是HF,X的氢化物是HCl,氢化物的沸点与非金属性没有必然的联系,B选项有一定的干扰能力;C项比较的是氢化物的稳定性,X的氢化物稳定,说明其非金属性强,举例如:稳定性HF>HCl>HBr>HI;D中Y单质能够将X的离子从其盐溶液中置换出来,说明Y非金属性强于X,与题干相反。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com