
题目列表(包括答案和解析)
17.随着溶液酸碱性的变化,酚酞分子结构发生转化而显示不同颜色:无色酚酞结构A红色酚酞结构B。在化学实验课上,细心的某同学发现:当无色的酚酞溶液滴入到氢氧化钠溶液中时,溶液立刻变成红色,但是随后红色溶液又逐渐变成无色。对此,许多同学纷纷发表看法,主要有三种推测:①红色酚酞结构被空气中的氧气氧化;②溶液吸收了空气中的二氧化碳,pH减小,红色退去;③红色酚酞结构自动转化为另外一种无色酚酞结构C。
为此在老师的指导下,同学们做了如下实验。分别取4 mL不同浓度的NaOH溶液于试管中,滴加2滴酚酞溶液,实验现象与数据如下表:
|
编号 |
静置 方式 |
NaOH溶液浓度 |
滴入2滴酚酞溶液 |
加热至 沸腾 |
冷却 |
再加热至沸腾 |
冷却 |
滴入适量稀盐酸 |
|
① |
敞口 |
1% |
变红,30 min后退色 |
变红 |
退色 |
变红 |
退色 |
变红 |
|
② |
密闭 |
1% |
变红,29 min后退色 |
变红 |
退色 |
变红 |
退色 |
变红 |
|
③ |
敞口 |
5% |
变红,7 min后退色 |
变红 |
退色 |
变红 |
退色 |
变红 |
|
④ |
密闭 |
5% |
变红,30 min后退色 |
变红 |
退色 |
变红 |
退色 |
变红 |
|
⑤ |
敞口 |
10% |
变红,1/2 min后退色 |
变红 |
退色 |
变红 |
退色 |
变红 |
|
⑥ |
密闭 |
10% |
变红,1/2 min后退色 |
变红 |
退色 |
变红 |
退色 |
变红 |
请回答下列问题:
(1)通过分析表中数据及现象,该组同学认为第①种推测不合理。理由是________________________________________________________________________。
(2)第②种推测也不合理。理由是________________________________________________________________________。
(3)红色酚酞结构B转化为无色酚酞结构C是否为可逆反应:________(填“是”或“否”),在各个滴入适量稀盐酸又变红的试管中加入足量稀盐酸产生的现象是________________________________________________________________________,
原因是____________________________________________________________________。
(4)红色酚酞结构B的热稳定性比无色酚酞结构C的热稳定性要________(填“强”或“弱”),红色酚酞结构B转化为无色酚酞结构C是一个________(填“吸”或“放”)热的过程。
解析:如果是①被空气中O2氧化的原因的话,酚酞结构将发生变化,正如HClO氧化退色反应物质一样,不会出现反复加热冷却,出现反复的变红和退色。
如果是②CO2的原因的话,②④⑥静置方式为封闭,隔绝了CO2,所以也不正确,只能是③。
答案:(1)对已退色的溶液反复加热冷却,出现反复的变红和退色 (2)②④⑥组实验在密闭时变红的溶液仍能退为无色 (3)是 退为无色 加入足量盐酸,溶液酸性增强,主要以无色酚酞结构A的形式存在 (4)强 放
16. (1)现有pH=2的HCl溶液100 mL,要使它的pH=3,如果加入蒸馏水,需加水________mL;如果加入pH=4的HCl溶液,需加入此HCl溶液________mL(假定溶液体积有加和性,下同)。
(2)将pH=8的NaOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH=________。
(3)将0.1 mol/L盐酸和0.06 mol/L氢氧化钡溶液等体积混合后,该混合溶液的pH=________。
(4)25℃时,10体积pH=a的某强酸与1体积pH=b的某强碱混合后,溶液呈中性,则a和b满足的关系__________________________________________________________。
解析:(1)设加入水的体积为x,加入盐酸溶液的体积为y,则有:
=10-3 mol/L,x=900 mL
=10-3 mol/L y=1 000 mL
(2)混合后c(OH-)==×10-3 mol/L
c(H+)=2×10-11 mol/L pH=10.7
(3)混合后OH-过量,c(OH-)==0.01 mol/L
c(H+)=1×10-12 mol/L pH=12
(4)10×10-a=1×10b-14 1015-a-b=1 a+b=15
答案:(1)900 1 000 (2)10.7 (3)12 (4)a+b=15
15.已知水在25℃和95℃时,其电离平衡曲线如下图所示:
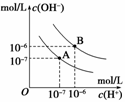
(1)则25℃时水的电离平衡曲线应为________(填“A”或“B”),请说明理由_____________________________________。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_________________________________________________________________。
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________________________________________________________________。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:________________________________________________________________________。
解析:本题的关键是搞清楚温度对水的电离平衡、水的离子积和溶液pH的影响。
(1)当温度升高时,促进水的电离,水的离子积也增大,水中氢离子浓度、氢氧根离子浓度都增大,水的pH变小,但溶液仍然呈中性。因此结合图像中A、B曲线变化情况及氢离子浓度、氢氧根离子浓度可以判断,25℃时水的电离平衡曲线应为A,理由为水的电离是吸热过程,升高温度,水的电离程度增大。
(2)25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)·10-5 mol/L=V(H2SO4)·10-4 mol/L,得V(NaOH)∶V(H2SO4)=10∶1。
(3)要注意是95℃时,水的离子积为10-12,即c(H+)·c(OH-)=10-12 mol2·L-2,即:等体积强酸强碱反应至中性时pH(酸)+pH(碱)=12。根据95℃时混合后溶液呈中性,pH2=b的某强碱溶液中c(OH-)=10b-12;有100×10-a=1×10b-12,即:10-a+2=10b-12,所以,有以下关系:a+b=14或pH1+pH2=14。
(4)在曲线B对应温度下,因pH(酸)+pH(碱)=12,可得酸碱两溶液中c(H+)=c(OH-),如是强酸、强碱,两溶液等体积混合后溶液应呈中性;现混合溶液的pH=5,即等体积混合后溶液显酸性,说明H+与OH-完全反应后又有新的H+产生,即酸过量,所以说酸HA是弱酸。
答案:(1)A 水的电离是吸热过程,温度低时,电离程度较小,c(H+)、c(OH-)较小 (2)10∶1 (3)a+b=14或pH1+pH2=14 (4)曲线B对应95℃,此时水的离子积为10-12 mol2·L-2,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5。
14.(2009·全国Ⅱ理综,10)现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是( )
A.④①②⑤⑥③ B.④①②⑥⑤③ C.①④②⑥③⑤ D.①④②③⑥⑤
解析:一般情况下,溶液等浓度时,pH由小到大的顺序是:强酸<弱酸<强酸弱碱盐<强酸强碱盐<强碱弱酸盐<弱碱<强碱,而盐溶液中,盐对应的酸越弱,其强碱弱酸盐碱性越强,故选C。
答案:C
13.室温下,在pH=12的某溶液中,分别有甲、乙、丙、丁四位同学计算出由水电离出的
c(OH-)的数据分别为:甲:1.0×10-7 mol/L;乙:1.0×10-6 mol/L;丙:1.0×10-2 mol/L;丁:1.0×10-12 mol/L。其中你认为可能正确的数据是( )
A.甲、乙 B.乙、丙 C.丙、丁 D.乙、丁
解析:如果该溶液是一种强碱(例如NaOH)溶液,则该溶液的OH-首先来自于碱(NaOH)的电离,水的电离被抑制,c(H+)=1×10-12 mol/L,所有这些H+都来自于水的电离,水电离时当然同时提供相同物质的量的OH-,所以丁是对的。如果该溶液是一种强碱弱酸盐溶液,则该溶液之所以呈碱性是由于盐中弱酸根水解的缘故。水解时,弱酸根离子与水反应生成弱酸和OH-,使溶液中c(OH-)>c(H+),溶液中的OH-由水电离所得,所以丙也是正确的。
答案:C
12. 已知稀盐酸的物质的量浓度为a mol/L,稀NaOH溶液的物质的量浓度为b mol/L,当两种溶液等体积混合时,所得溶液的pH=2(混合液体积为原体积的和),则a和b的关系为( )
A.a=b/2 B.b=a/2 C.a=b+0.1 D.a=b+0.02
解析:因为NaOH+HCl===NaCl+H2O
1 1
b·V a·V
所以 10-2==,a=b+0.02。
答案:D
11.重水(D2O)在25℃时,KW=10-12 mol2·L-2,定义pD=-lg[c(D+)],pOD=-lg[c(OD-)],
则下列说法正确的是( )
A.25℃时,纯重水中pD=7
B.25℃时,0.1 mol/L NaCl的重水溶液中pD=pOD=7
C.25℃时,1 mol/L的DCl重水溶液pD=0,pOD=12
D.25℃时,0.01 mol/L的NaOD溶液中pOD=10
解析:由于重水的KW=10-12 mol2·L-2,故纯重水中的pD=6,溶液中pD+pOD=12,中性溶液中pD=pOD=6。
答案:C
10.下列叙述正确的是( )
A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)×c(OH-)=1×10-14 mol2·L-2
B.c(H+)等于1×10-7 mol/L的溶液一定是中性溶液
C.0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol/L CH3COOH溶液中的c(H+)的2倍
D.任何浓度的溶液都可以用pH来表示其酸性的强弱
解析:KW=[H+]·[OH-] ,且KW只与温度有关,所以,在常温下,纯水,酸性、碱性或中性稀溶液,其KW=1×10-14 mol2·L-2;在温度不确定时,中性溶液里的c(H+)不一定等于1×10-7 mol/L;0.2 mol/L CH3COOH溶液中的CH3COOH电离程度比0.1 mol/L CH3COOH溶液中的CH3COOH电离程度小,所以,0.2 mol/L CH3COOH溶液中的c(H+)小于0.1 mol/L CH3COOH溶液中的c(H+)的2倍;当c(H+)或c(OH-)大于1 mol/L时,用pH表示溶液的酸碱性就不简便了,所以,当c(H+)或c(OH-)大于1 mol/L时,一般不用pH表示溶液的酸碱性,而是直接用c(H+)或c(OH-)来表示。
答案:A
9. 室温时,将x mL pH=a的稀NaOH溶液与y mL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是( )
A.若x=y,且a+b=14,则pH>7 B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7 D.若x=10y,且a+b=14,则pH>7
解析:本题主要考查有关pH的简单计算。由题意知:
n(NaOH)=10-3·x·10a-14 mol,n(HCl)=10-3·y·10-b mol,所以n(NaOH)∶n(HCl)==×10(a+b-14)。若x=y,且a+b=14,则n(NaOH)=n(HCl)二者恰好完全反应,pH=7;若10x=y且a+b=13,则碱不足,pH<7;若ax=by且a+b=13则n(NaOH)∶n(HCl)=·<1,故pH<7;若x=10y且a+b=14,则n(NaOH)∶n(HCl)=10>1,NaOH过量,pH>7。
答案:D
8.(2008·广东卷)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。右图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
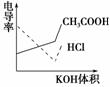
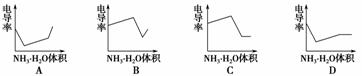
解析:HCl为强电解质,CH3COOH为弱电解质,滴加NH3·H2O,其先与HCl反应,生成同样为强电解质的NH4Cl,但溶液体积不断增大,溶液被稀释,所以电导率下降。当HCl被中和完后,NH3·H2O继续与弱电解质CH3COOH反应,生成强电解质CH3COONH4,所以电导率增大。HCl与CH3COOH均反应完后,继续滴加NH3·H2O,电导率变化不大,因为溶液被稀释,所以有下降趋势。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com