
题目列表(包括答案和解析)
1.掌握乙醇、苯酚、乙酸的结构、性质及醇、酚、羧酸相互转变关系。
5.(17分)某学生欲配制6.0mol·L-1的H2SO4溶液1000mL,实验室有三种不同浓度的硫酸:①480mL 0.5 mol·L-1的硫酸;②150mL 25%的硫酸(ρ=1.18g·mL-1);③足量的18 mol·L-1的硫酸。有三种规格的容量瓶:25mL、500mL、1000mL。老师要求把①、②两种硫酸全部用完,不足的部分由③来补充。请回答下列问题:
(1)实验中25%的硫酸的物质的量浓度为 mol·L-1(保留1位小数)
(2)配制该硫酸溶液应选用容量瓶的规格为 mL。
(3)配制时,该同学操作顺序如下,并将操作步骤D补充完整。
A.将①、②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18 mol·L-1的浓硫酸 mL,沿玻璃棒倒入上述混
合液中。并用玻璃棒搅动,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D. ;
E.振荡,继续向容量瓶中加入,直到液面接近刻度线1~2cm;
F.改用胶头滴加水,使溶液的凹液面恰好与刻度相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D对所配溶液浓度有何影响: 。(填“偏大”“偏小”或“无影响”)
(5)进行操作C前还需注意 。
4.(共17分)乙二酸通常以二水台物的形式存在,俗称草酸晶体。已知草酸晶体在101℃时熔化并开始升华,157℃时大量升华,继续升温会分解生成CO、CO2和H2O。
(1)下列关于乙二酸的叙述正确的是(填序号) 。
①能和乙二醇发生酯化反应 ②能使酸性高锰酸钾溶液褪色
③其溶液能使蓝色石蕊试纸变红 ④能和碳酸氢钠溶液反应生成气体
欲验证上述性质,除用到胶头滴管、试管和玻璃导管外,还必需要使用的玻璃仪器
有 。
(2)乙二酸的工业生产方法之一是以乙二醇为原料,在一定条件下用空气氧化得到。写出该反应的化学方程式 。
 (3)欲检验草酸晶体受热分解的产物中是否有C02,甲、乙两位同学分别设计了装置1、装置2(见下图)来完成实验(部分夹持装置已略去)。
(3)欲检验草酸晶体受热分解的产物中是否有C02,甲、乙两位同学分别设计了装置1、装置2(见下图)来完成实验(部分夹持装置已略去)。
(I)简述检验装置I气密性的操作方法 。
(Ⅱ)B和 E两个装置中更合理的是 ,理由为 。
(III)请从A-F中选择台适的仪器,组装一套可更好达到实验日的的装置,按照气流由左到右的顺序依次为(用字母表示) 。
3.(15分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
①称取a g样品,置于烧杯中;
②加适量盐酸和适量蒸馏水使样品溶解,准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。
请根据上面叙述,回答:
 (1)上图仪器中,实验步骤①②③中必须用到的仪器是E和
(填仪器序号)。
(1)上图仪器中,实验步骤①②③中必须用到的仪器是E和
(填仪器序号)。
(2)写出步骤③中发生反应的离子方程式 。
(3)洗涤沉淀的操作是 。
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是 。
(5)若坩埚质量是W1 g,最终坩埚和固体的总质量是W2 g,则样品中铁元素的质量分数为 。
1.(本题共17分)
 干燥纯净的氯气与氨气反应除得到氮气外,还有另一种产物。某研究小组在探究该产物时设计了如下实验:
干燥纯净的氯气与氨气反应除得到氮气外,还有另一种产物。某研究小组在探究该产物时设计了如下实验:
实验中观察到D装置中先出现浓厚的白烟,后在内壁凝结成白色固体。请回答下列问题:
(1)为达到实验目的,E装置中的试剂是 (填试剂名称),
C装置可选用下表中的 装置(填字母编号);
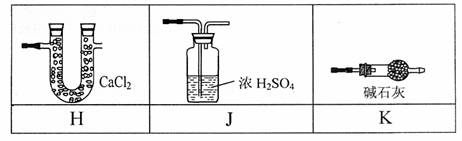
(2)为使实验顺利进行,请简述A、F中的分液漏斗的正确操作方法
。
(3)装置A中发生反应的化学方程式是 ;当反应过程中转移5mole-,则生成的气体在标准状况下的体积约是 L;
(4)将装置D中生成的白色固体取出,并与适量熟石灰充分混合加热,得到一种能使湿润的红色石蕊试纸变蓝的气体。
写出该反应的化学方程式 ;
(5)装置D中发生反应的化学方程式是 ;
 2.(14分)有以下两个实验装置图,请按要求回答问题。
2.(14分)有以下两个实验装置图,请按要求回答问题。
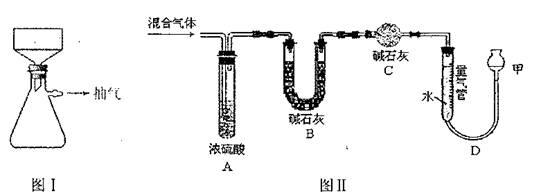
(1)装置图I是一个抽滤装置,可用于加快过滤速度。试根据图示,简述其之所以能加快过滤速度的原理 。
(2)已知某一元醇燃烧得到CO、CO2、水蒸气的混合气体。装置图II可用于确定该一元醇的实验式。(假设每步均能完全吸收)
①C装置的作用是 。
②为了准确地测量气体的体积,实验前后在读取量气管中液面的读数时,应注意 。(填写字母编号)
a.视线与凹液面最低处相平
b.等待片刻,待甲装置中液面不再上升时立刻读数
c.读数时应上下移动甲装置,使甲装置中的液面与量气管中的液面相平
③实验结束测知A装置增重0.36g,B装置增重0.40g,进入量气管的气体的体积为折算成标准状况),则该一元醇的实验式是 。
21.由碳、氢、氧三种元素组成的某有机物,分子中共含有10个原子,其原子核外共有32个电子,lmol该有机物在氧气中完全燃烧时需要4molO2,回答:
(1)求该有机物的分子式。
(2)若该有机物可使溴水褪色,但不发生银镜反应,取0.2mol该有机物与足量钠反应,能产生2.24L H2(标准状况),则该有机物的结构简式可能是什么?
(3)若该有机物能发生银镜反应,则其结构简式是什么?
20.(10分)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
 CH3COOH+C2H5OH
CH3COOH+C2H5OH
 CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有 、
等。
(2)若用右图所示装置来制备少量的乙酸乙酯,产率往往偏低,
其原因可能为 _____________、
________________________等。
(3)此反应以浓硫酸为催化剂,可能会造成 __________、__________________等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
|
同一反应时间 |
同一反应温度 |
||||
|
反应温度/℃ |
转化率(%) |
选择性(%) |
反应时间/h |
转化率(%) |
选择性(%) |
|
40 |
77.8 |
100 |
2 |
80.2 |
100 |
|
60 |
92.3 |
100 |
3 |
87.8 |
100 |
|
80 |
92.6 |
100 |
4 |
92.3 |
100 |
|
120 |
94.5 |
98.7 |
6 |
93.0 |
100 |
|
选择性100%表示反应生成的产物是乙酸乙酯和水 |
①根据表中数据,下列 (填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h
C.60℃,4h D.40℃,3h
② 当反应温度达到120℃时,反应选择性降低的原因可能为?
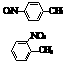
19.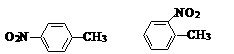 (5分)
(5分)
⑴ 和 的一些物理性质如下表:
|
物 质 |
熔 点 |
沸 点 |
密 度 |
水溶性 |
 |
-10℃ |
212℃ |
1.1622g/mL |
不溶于水 |
|
|
54℃ |
238℃ |
1.1581g/mL |
不溶于水 |
①分离这两种物质混合物可采用的方法是_______________。(填序号)
A.过滤 B.分液 C.蒸发 D.分馏
②实验需要用到的主要玻璃仪器是________________________________________。
18.(8分)肉桂醛是一种食用香精,它广泛用于牙膏、洗涤剂、糖果以及调味品中。工业上可通过下列反应制备:
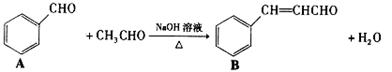
(1)请推测B侧链上可能发生反应的类型: 、 (任填两种)
(2)请写出两分子乙醛在上述条件下反应的化学方程式:
(3)请写出同时满足括号内条件下的所有同分异构体的结构简式:
(①分子中不含羰基和羟基 ②是苯的对二取代物 ③除苯环外,不含其他环状结构。)
17.(12分)某液态卤代烷RX(R是烷基,X是某种卤素原子)的密度是a g/cm3。该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和HX。为了测定RX的相对分子质量,拟定的实验步骤如下:
①准确量取该卤代烷b ml,放入锥形瓶中;
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应;
③反应完全后,冷却溶液,加稀HNO3酸化,滴加过量AgNO3溶液,得白色沉淀;
④过滤,洗涤,干燥后称重,得到c g固体。
请回答下面问题:
(1)装置中长玻璃管的作用是 ;
(2)步骤④中,洗涤的目的是为了除去沉淀上吸附的 离子;
(3)该卤代烷中所含的卤素是 ,判断的依据是 ;
(4)该卤代烷的相对分子质量是 ;
(5)如果在步骤③中所加HNO3的量不足,没有将溶液酸化,则步骤④中测得的c值将会 。
(A)偏大 (B)偏小 (C)不变 (D)大小不定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com