
题目列表(包括答案和解析)
2.现有①Al2(SO4)3、②Ba(NO3)2、③NaOH、④CuCl2、⑤KCl等5种溶液,不加任何试剂就可鉴别出的先后顺序正确的是( )
A.④③①②⑤ B.③④①②⑤ C.②③④①⑤ D.⑤④③②①
解析:由外观特征可确定CuCl2,再向余下的四种试剂中加入CuCl2,有蓝色沉淀生成的即为NaOH,再将过量的NaOH溶液加入余下的3种试剂中,可确定Al2(SO4)3,再利用Al2(SO4)3确定Ba(NO3)2和KCl。
答案:A
1.用右图所示装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因分析中,一定错误的是( )
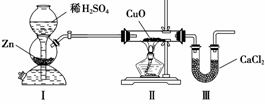
A.Ⅰ、Ⅱ装置之间缺少干燥装置
B.Ⅲ装置之后缺少干燥装置
C.Ⅱ装置中玻璃管内有水冷凝
D.CuO没有全部被还原
解析:A、B、C均导致测得反应后生成水的质量增加,氢元素的质量偏大;A、B项测得氧元素的质量为真实值,则氢元素质量偏大,故有m(H)∶m(O)>1∶8;C中测得的氧元素的质量偏小(因Ⅱ装置中玻璃管内有水冷凝),这时测得的氢元素的质量为“真实值”,故有m(H)∶m(O)>1∶8。
答案:D
13.某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:

(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于________上(用以下所给仪器的编号填入,下同),取用坩埚应使用________,灼烧后的坩埚应放在________上,不能直接放在桌面上。
实验所用仪器:A.蒸发皿 B.石棉网 C.泥三角 D.表面皿 E.坩埚钳 F.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是( )
A.灼烧过程中部分氧化铜被还原 B.灼烧不充分铜未被完全氧化
C.氧化铜在加热过程中分解生成铜 D.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、________、冷却结晶、________、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:________________________________________________________________________、
__________________________。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行______次。
(6)若测定结果x值偏高,可能的原因是________。
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
解析:(1)因坩埚加热后温度较高,应放在泥三角上进行加热,且取用坩埚时要用坩埚钳,并且为防止坩埚炸裂和烧坏桌面,灼烧后的坩埚要在石棉网上冷却,不能直接放在桌面上。
(2)灼烧后含有少量铜其原因可能是灼热不充分,铜未被完全氧化,也可能是灼烧过程中部分氧化铜被还原。
(3)利用途径Ⅱ制取胆矾时,必须先加酸将氧化铜溶解,加热通氧气将Cu氧化,过滤除去粗制氧化铜中的不溶物杂质后,然后再蒸发溶剂,冷却结晶,再过滤得晶体,最后将其干燥,由此可写出答案。
(4)根据途径Ⅰ的反应方程式Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O和途径Ⅱ的反应方程式2Cu+O2+2H2SO4(稀)2CuSO4+2H2O,可以看出途径Ⅱ的优点是:①产生等量的胆矾比途径Ⅰ耗硫酸少;②途径Ⅱ不产生污染大气的气体(SO2)。
(5)称量操作至少进行4次,分别是:①称量坩埚;②称量加入晶体后的坩埚;③称量加热冷却后的坩埚;④称量再加热、再冷却后的坩埚至两次称量的值相差不超过0.1 g。
(6)若测定结果x值偏高,可能是加热温度过高使CuSO4晶体中的CuSO4分解了,其他三项均使x值偏低。
答案:(1)C E B (2)AB (3)蒸发浓缩 过滤 (4)产生等量胆矾途径Ⅱ消耗硫酸少 途径Ⅱ不会产生污染大气的气体 (5)4 (6)a


12.某学生设计了一套验证物质化学性质的实验装置(如图):
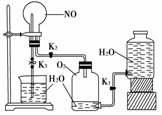
请完成下列问题:
(1)该实验的目的是_______________________________________________________。
(2)该实验的反应物质是(用化学方程式表示)_________________________________________________________________________。
(3)实验用品:实验仪器除铁架台(带铁夹)、储气瓶(两个)、直管活塞(K1、K2)、止水夹(K3)、橡胶管、橡胶塞以及若干玻璃管连件外,还有哪几种(写仪器名称)________,实验所用试剂为________。
(4)检查本装置气密性的最好方法是________________________________________________________________________
________________________________________________________________________。
(5)实验步骤:①按上图连接好仪器装置;②扭开活塞K1和K2,主要现象为____________;③关闭活塞K1和K2,打开止水夹K3,要使烧瓶内产生喷泉可采用的方法是________________________________________________________________________。
解析:(1)因题干中注明该装置是验证物质化学性质的装置,将此信息与图中物质相关联,可知目的为验证NO易被氧气氧化和NO2可与H2O反应的性质。
(2)2NO+O2===2NO2,3NO2+H2O===2HNO3+NO
(3)纵观整套装置,除题干所述的仪器外,还剩下的主要仪器有圆底烧瓶和烧杯,所用试剂也由读图可知。
(4)检查装置的气密性属于中学实验的常考考点,类似的考题较多。本问应从装置的特点来思考。可用储水瓶中的水排储气瓶中的空气至圆底烧瓶中,使之形成水压。若装置不漏气,则储气瓶中水位将不再上升。
(5)②通过现象变化反映物质的性质,③从喷泉的反应物质出发寻找答案。因为当外压大于内压时喷入,如课本中氨水的喷泉实验;当内压大于外压时喷出,如火山喷发。本操作应抓住NO2与H2O接触后发生反应而导致体积减小去思考,要特别留心“打开K3”这一环节。
答案:(1)验证NO与O2反应、NO2与H2O反应
(2)2NO+O2===2NO2,3NO2+H2O===2HNO3+NO
(3)圆底烧瓶和烧杯 NO、O2、H2O
(4)安装好装置,先夹上K3,关闭K1,打开K2,在储水瓶中装入水。再打开K1,使水注入储气瓶。片刻,储气瓶中水位不再上升,储水瓶中水位不再下降,则装置气密性良好,否则其气密性不好
(5)盛NO的烧瓶内出现红棕色,盛O2的储气瓶中液面上升,储水瓶中液面下降 用手或热毛巾捂住圆底烧瓶
11.(2008·全国Ⅱ理综,28)某钠盐溶液可能含有阴离子NO,CO,SO,SO,Cl-,Br-,I-。为鉴定这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;②加HCl后,生成无色无味气体。该气体能使饱和石灰水溶液变浑浊;③加CCl4,滴加少量氯水,振荡后,CCl4层未变色;④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;⑤加HNO3酸化后,再加过量AgNO3溶液,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一实验鉴定离子的结论与理由。
实验①___________________________________________________________________;
实验②____________________________________________________________________;
实验③____________________________________________________________________;
实验④____________________________________________________________________;
实验⑤____________________________________________________________________。
(2)上述5个实验不能确定是否存在的离子是________________________________________________________________________。
解析:(1)①测得混合液呈碱性,则一定至少含有SO和CO中的一种,因为它们水解显碱性;②加入HCl后,生成无色无味能使澄清石灰水变浑浊的气体,则一定有CO,而无SO,若有SO,则会产生有刺激性气味的SO2气体;③加入CCl4并滴加氯水,CCl4层未变色,说明一定无I-和Br-,若有Br-和I-,氯水会将它们氧化生成Br2和I2;④加入BaCl2能产生不溶于稀盐酸的白色沉淀,则一定有SO;⑤加入HNO3酸化后,再加入过量的AgNO3产生了白色沉淀,则一定有Cl-,产生了AgCl沉淀。
(2)不能确定的只有NO。
答案:(1)①CO和SO可能存在,因它们水解显碱性
②CO肯定存在,因产生的气体是:CO2;SO不存在,因为没有刺激性气味的气体产生
③Br-,I-不存在,因没有溴和碘的颜色出现
④SO存在,因BaSO4不溶于盐酸
⑤Cl-存在,因与Ag+形成白色沉淀
(2)NO
10.实验室需要纯净的NaCl溶液,但现有的NaCl晶体混有少量Na2SO4和(NH4)2CO3,请设计实验除去杂质,并回答下列问题:
(1)除去(NH4)2CO3用加热好还是加强碱后再进行加热好?
你选择的是________,其理由是________________________________________________________________________。
判断(NH4)2CO3已除尽的方法是________________________________________________________________________。
(2)除去SO的方法是________________________________________________________________________。
判断SO已除尽的方法是________________________________________________________________________。
解析:比较NaCl和(NH4)2CO3的性质差异结合除杂的基本原则,不难得出加热好。判断(NH4)2CO3是否被除尽时,要注意的只能用盐酸,否则会带来杂质。除去SO是使用过量的BaCl2溶液,接着又要用过量的Na2CO3溶液来除去过量的BaCl2(二者不能颠倒),最后用适量的盐酸除去过量的Na2CO3。
答案:(1)加热好 因加热操作简单节省试剂,且不引入新的杂质 将残留物溶于水后加盐酸,看是否有气泡产生 (2)先加入过量BaCl2溶液,再加入过量Na2CO3溶液,过滤后,滤液中加入盐酸 取加入BaCl2后的上层清液,再滴入少量BaCl2,看是否有白色沉淀生成
9. 近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等。这里的“绿色”是对人类社会可持续发展战略的形象表述。“绿色化学”要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列4个方案中,你认为可行并且符合“绿色化学”要求的方案是( )
A.MgMg(NO3)2
B.MgMgCl2Mg(OH)2Mg(NO3)2
C.MgMgOMg(NO3)2
D.MgMgSO4Mg(NO3)2
解析:A、D项在反应过程中均产生了污染环境的物质,且原料利用率低;B项中步骤较复杂,所用试剂较多,浪费了资源;C项步骤简单,原料丰富,利用率高。
答案:C
8.下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是( )
A.Ba(OH)2、KSCN、NaCl、Mg(NO3)2(FeCl3溶液)
B.NaNO3、NaHCO3、(NH4)2SO3、Na2SiO3(H2SO4溶液)
C.NH4Br、K2CO3、NaI、CaCl2(AgNO3溶液)
D.(NH4)3PO4、NaBr、CuSO4、AlCl3(KOH溶液)
解析:本题是用一种试剂鉴别多种物质的实验题,着重考查学生对常见物质的化学性质、物理性质的掌握情况,以及鉴别实验方案的设计能力的考查。
A中可先利用FeCl3鉴别出Ba(OH)2[产生红褐色Fe(OH)3沉淀]和KSCN(产生血红色溶液),然后再利用Ba(OH)2鉴别出Mg(NO3)2(产生白色沉淀),最后一种为NaCl,故能鉴别;B中可利用将H2SO4分别加入四种溶液中,产生无色无味气体的为NaHCO3,产生白色沉淀的为Na2SiO3,产生刺激性气味气体的为(NH4)2SO3,余下的为NaNO3,故能鉴别;D中可利用将KOH分别逐滴加入四种溶液中,产生蓝色沉淀的为CuSO4,先产生白色沉淀后又溶解的为AlCl3,加热有刺激性气味气体产生的为(NH4)3PO4的方法来鉴别。故选C。
答案:C
7.下列各组物质仅用蒸馏水不能鉴别出的是( )
A.苯、酒精、硝基苯 B.食盐、烧碱、硝酸铵
C.蔗糖、硫酸铜粉末、碳酸钙粉末 D.氧化铜、二氧化锰、活性炭
解析:A中酒精与水互溶不分层,苯与水、硝基苯与水均能出现分层,苯在水的上层,而硝基苯则在水的下层;B中利用溶解放热吸热鉴别;C中碳酸钙不溶于水,蔗糖水溶液呈无色,硫酸铜粉末溶于水显蓝色,答案为D。
答案:D
6.对下列各组物质:①NaNO3和NaCl;②CaCl2和CaCO3;③MnO2和KCl;④BaSO4和AgCl,可按照溶解、过滤、蒸发的实验操作顺序,将它们相互分离的是( )
A.只有① B.③④ C.②③ D.②④
解析:要将两种固体按溶解、过滤、蒸发的实验操作顺序分离,必需的条件是其中一种固体难溶于水,另一种固体易溶于水。对于所给出的物质组:①两者都易溶;④两者都难溶,均不能用指定的方法分离。②CaCl2易溶,CaCO3难溶;③MnO2难溶,KCl易溶,可用指定方法分离。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com