
题目列表(包括答案和解析)
3. 下列说法正确的是( )
A. 200 mL 1 mol·L-1 Al2(SO4)3溶液中,Al3+和SO离子总数为6.02×1023
B.标准状况下,22.4 L Cl2和HCl的混合气体中含分子总数为2×6.02×1023
C.0.1 mol Br原子中含中子数为3.5×6.02×1023
D.30 g甲醛中含共用电子对总数为×6.02×1023
解析:A项中Al3+水解,使Al3+与SO离子总数小于6.02×1023;B项中分子总数为
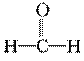
2.在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A.两种气体的压强相等 B.O2比O3的质量小
C.两种气体的分子数目相等 D.两种气体的氧原子数目相等
解析:根据m=ρV,体积、密度相等的O2、O3的质量相等,物质的量之比为∶=3∶2,压强之比为3∶2,分子数目之比为3∶2,O原子数目之比为∶=1∶1。正确答案为D。
答案:D
1.(2009·广东化学,6)设nA代表阿伏加德罗常数(NA)的数值,下列说法正确的是( )
A. 1 mol硫酸钾中阴离子所带电荷数为nA
B.乙烯和环丙烷(C3H6)组成的28 g混合气体中含有3nA个氢原子
C.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为nA
D.将0.1 mol氯化铁溶于1 L水中,所得溶液含有0.1nA个Fe3+
解析:A项,1 mol硫酸钾中阴离子所带电荷数为2nA;B项,应含有4nA个氢原子;D项,由于Fe3+水解,所得溶液含有的Fe3+个数小于0.1nA。
答案:C
21.有些膨化食品包装袋中有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰所属的物质类别是 (用序号填空)。
①金属氧化物 ②碱性氧化物 ③碱 ④碱性干燥剂
(2)生石灰可作干燥剂的理由是(用化学方程式表示) 。
(3)你认为下列内容还必须在这种小纸袋上注明的是 (用序号填空)。
①禁止食用 ②可以食用 ③禁止未成年人用手拿 ④生产日期
(4)硅胶(主要成分是H2SiO3)也是一种很好的干燥剂。用硅胶作食品干燥剂比用生石灰好的理由是__(用序号填空)。
①腐蚀性低 ②可释放出营养素 ③使用时间长
解析:二氧化硅的化学性质很稳定,无腐蚀性。
答案:(1)①②④ (2)CaO+H2O===Ca(OH)2 (3)①④ (4)①
20.①渗析 ②盐析 ③凝聚 ④溶胶 ⑤凝胶 ⑥布朗运动 ⑦电泳 ⑧丁达尔现象
⑨中和 ⑩水解。从中选出适宜的词语填入下列每小题的空格中:(填编号)
(1)肥皂水中透过强光,可以见到光带。这种现象称为 。
(2)在浓肥皂水中加入饱和食盐水(或固体含有的细粒)肥皂凝聚。这种现象称为 。
(3)在肥皂水中加入酚酞试液,肥皂水变成红色,说明高级脂肪酸根离子发生了 。
(4)在氢氧化铁胶体中加入硫酸铵,产生红褐色沉淀,这种现象叫做 。
(5)用半透膜把制取的氢氧化铁胶体中含有的NaCl分离出来的方法叫做 。
解析:根据胶体的性质可以准确解答,但要注意肥皂水是胶体。
答案:(1)⑧ (2)② (3)⑩ (4)③ (5)①
19.中学化学中几种常见物质的转化关系如图:

将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围: 。
(2)A、B、H的化学式:A 、B 、H 。
(3)写出C的酸性溶液与双氧水反应的离子方程式: 。
(4)写出鉴定E中阳离子的实验方法和现象: 。
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式: 。
解析:根据D溶液滴入沸水中可以得到以F为分散质的红褐色胶体,可知F为Fe(OH)3胶体,D中含Fe3+,因为D是B与过量浓H2SO4反应得到,所以D为Fe2(SO4)3溶液。再根据ACD,可知A为Fe,C为FeSO4,同时可知B为FeS。根据D与氨水的反应,可知E为(NH4)2SO4。根据Fe(OH)3胶体加入Fe(A)与H可得到FeSO4溶液,说明H是H2SO4。
答案:(1)1 nm-100 nm (2)Fe FeS H2SO4(稀) (3)2Fe2++H2O2+2H+===2Fe3++2H2O (4)取少量E放于试管中,用胶头滴管滴入NaOH溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝。(或其他合理答案) (5)4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+O2↑+8Na+
18.现有BaCl2,MgSO4,(NH4)2SO4、KCl、AgNO3、和KOH六种未知溶液,为了鉴别它们,将它们任意编号为A、B、C、D、E、F,现将它们两两混和(必要时可微热),实验结果如右表。(其中“-”表示无明显现象,“↑”表示生成气体,“↓”表示生成沉淀或微溶物质)则A. 、B. 、C. 、D. 、E. 、F. 。

解析:这是一道推断题,主要考查了碱与盐、盐与盐的反应规律的应用。若盐与盐能反应,则生成物中必定生成沉淀或微溶物质,若无明显现象,则说明盐与盐不能反应,若碱与盐反应时,一般生成沉淀,(当铵盐与可溶性碱作用时必有气体NH3和水生成)若无明显现象则说明该碱和盐不能反应,利用这些反应的特征现象,从而可推断出各种物质,由表可知B物质能与其它五种物质均能反应且都有沉淀生成,则B物质为AgNO3,而F只与B反应,与其它四种物质均不反应,则F为KCl。A与D能反应且能放出气体,则A、D应为(NH4)2SO4和KOH,而A能与C反应生成沉淀,不能与E反应,D能与E反应产生沉淀,不能与C反应,故A应为(NH4)2SO4,D应为KOH,C为BaCl2,E为MgSO4。
答案:(NH4)2SO4 AgNO3 BaCl2 KOH MgSO4 KCl
17.有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是 。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是 。
此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为__。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)溶液在一定条件下反应,可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是 。
解析:本题通过对硫、氯、铁三种常见元素的推断,主要考查了化学方程式、离子方程式的书写,胶体知识,有关热量问题的计算和氧化还原反应的计算等问题,注重考查学生的分析能力和判断能力。
因X2-、Y-均与Y的氢化物具有相同的电子数,说明X、Y同周期,且分别属ⅥA和ⅦA族元素,又根据ZY3溶液遇苯酚呈紫色,推知ZY3为FeCl3,即X、Y、Z分别是硫、氯、铁元素,从而可如下作答:(1)为HClO4,(2)Fe3++3H2O△,Fe(OH)3(胶体)+3H+,因此液体为胶体,因而具有a、b、d的性质。关于(3)问,因X的单质在空气中燃烧产生的气体为SO2,SO2与O2的反应是可逆反应,根据题设条件,产生176.4 kJ热量时消耗的气体(SO2)的物质的量为1 mol×=1.8 mol,所以其转化率为×100%=90%.再由题设条件中Y的含氧酸盐常用于制O2,知该盐为KClO3,所以Y的酸为HClO3,故SO2与1.5 mol HClO3反应转移1.5×6.02×1023个电子时的化学方程式为SO2+2HClO3===H2SO4+2ClO2。
答案:(1)HClO4
(2)Fe3++3H2OFe(OH)3(胶体)+3H+ abd
(3)①90% ②SO2+2HClO3===H2SO4+2ClO2
16. 某化学兴趣小组欲研究H2SO4、KCl、Na2SO3、Na2CO3、NaCl、NaOH的性质,对于如何研究,他们设计了两种研究方案:
方案Ⅰ:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案Ⅱ:将它们按照钠盐、钾盐和其他化合物分类,然后分别溶于水得到溶液,进行实验。
(1)根据方案Ⅰ进行分类时,某同学认为Na2SO3、Na2CO3溶液都显碱性,于是将Na2SO3、Na2CO3与NaOH都划分为碱类,是否合理?
(2)在方案Ⅰ中,某同学发现盐类物质中的KCl、NaCl两种物质,它们在与其他物质混合时现象相同,无法区分,你能设计一种简单的方法区分这两种物质吗?
(3)在方案Ⅱ中,三种钠盐用其他物质中的 可加以区分,有关反应的化学方程式分别为: 。
(4)该兴趣小组中的一位同学认为,还可以根据是否含有钠元素将上述六种物质分为Na2SO3、Na2CO3、NaCl、NaOH和H2SO4、KCl两类。在用H2SO4鉴别四种含钠元素的物质时,Na2SO3和Na2CO3很容易得到了区分,但鉴别NaCl和NaOH时却陷入了困境,你能帮忙解决这一难题吗?
解析:判断物质所属的类别及利用实验探究物质的性质要注意物质的组成,例如:Na2CO3、Na2SO3都是盐,即使溶液显碱性也不能看作是碱。
答案:(1)不合理,Na2CO3和Na2SO3均属于盐类,只是它们水解显碱性。
(2)利用焰色反应,焰色反应呈紫色的为KCl,焰色反应呈黄色的为NaCl。
(3)H2SO4 Na2CO3+H2SO4===Na2SO4+CO2↑+H2O,Na2SO3+H2SO4===Na2SO4+SO2↑+H2O
(4)在两支试管中分别加入少许H2SO4溶液,分别加入稍过量的两种未知溶液,充分混合后,再向混合溶液中分别滴加Na2CO3溶液,若有气泡生成,则加入的未知溶液为NaCl溶液;若无气泡生成,则加入的未知溶液为NaOH溶液
15.(1)下列关于氧化物的各项叙述正确的是__。
①酸性氧化物肯定是非金属氧化物 ②非金属氧化物肯定是酸性氧化物 ③碱性氧化物肯定是金属氧化物 ④金属氧化物都是碱性氧化物 ⑤酸性氧化物均可与水反应生成相应的酸 ⑥与水反应生成酸的氧化物不一定是酸酐,与水反应生成碱的氧化物不一定是碱性氧化物 ⑦不能跟酸反应的氧化物一定能跟碱反应
(2)下列判断正确的是__。
①分散系一定是混合物 ②浊液可用过滤的方法分离 ③任何物质在水中都有一定的溶解度 ④任何溶胶中加入可溶性电解质后都能使胶体微粒凝成较大颗粒形成沉淀析出 ⑤丁达尔现象、布朗运动、电泳现象都是胶体特有的性质 ⑥因为胶粒比溶液中溶质粒子大,所以可以用过滤的方法把胶粒分离出来 ⑦饱和溶液一定比不饱和溶液的浓度大
⑧氢氧化铁胶体稳定存在的主要原因是胶粒作布朗运动
解析:本题主要围绕基本概念的理解,要注意其内涵、外延和本质。
答案:(1)③⑥ (2)①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com