
题目列表(包括答案和解析)
1.(原创)某同学在观看电视广告时,对“朴雪”口服液中含有Fe2+或Fe3+产生了浓厚兴趣,他采取了下列做法,你认为不合理的是( )
A. 由于维生素C具有还原性,可以和朴雪口服液同时服用
B.在检验铁的价态时,该同学先滴入KSCN溶液后滴入氯水,能判断出铁元素的价态
C.在检验铁元素的价态时,该同学先滴入氯水,后滴入KSCN溶液
D.Cl2能够将Fe2+氧化为Fe3+
解析:人体能够吸收的铁是+2价的,故口服液中应含有Fe2+,在检验时应先滴加KSCN溶液无明显现象,再滴入氯水显红色,则证明口服液中含有Fe2+。
答案:C
17.(2008·宁夏理综,25)已知可逆反应:M(g)+N(g)  P(g)+Q(g);ΔH>0,请回答下列问题:
P(g)+Q(g);ΔH>0,请回答下列问题:
(1)某温度下,反应物的起始浓度分别为:c(M)=1 mol/L,c(N)=2.4 mol/L;达到平衡后,M的转化率为60%,此时N的转化率为________;
(2)若反应温度升高,M的转化率________(填“增大”“减小”或“不变”);
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=4 mol/L,c(N)=a mol/L;达到平衡后,c(P)=2 mol/L,a=________;
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol/L,达到平衡后,M的转化率为________。
解析:(1)M(g) + N(g) P(g)+Q(g)
P(g)+Q(g)
始态 1 mol/L 2.4 mol/L 0 0
变化量 1 mol/L×60% 1 mol/L×60%
因此N的转化率为:×100%=25%
(2)由于该反应的ΔH>0,即正反应为吸热反应,因此升高温度,平衡右移,M的转化率增大。
(3)根据(1)可求出各平衡浓度:
c(M)=0.4 mol/L c(N)=1.8 mol/L,c(P)=0.6 mol/L c(Q)=0.6 mol/L
因此化学平衡常数K===
由于温度不变,因此K不变,达到平衡后
c(P)=2 mol/L c(Q)=2 mol/L,c(M)=2 mol/L c(N)=(a-2)mol·L-1
k===
解得a=6
(4)设M的转化率为x,则达到平衡后各物质的平衡浓度分别为:
c(M)=b(1-x)mol/L c(N)=b(1-x)mol/L,c(P)=bx mol/L c(Q)=bx mol/L
K===,解得x=41%
答案:(1)25% (2)增大 (3)6 (4)41%
16.恒温、恒压下,在一个容积可变的容器中发生如下反应:
N2(g)+3H2(g)  2NH3(g)
2NH3(g)
(1)若开始时放入1 mol N2和3 mol H2,达到平衡后,生成a mol NH3,这时N2的物质的量为________mol。
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入N2和H2的物质的量分别为________mol和________mol(平衡时NH3的质量分数与(1)中相同)。
(3)若开始时放入x mol N2、6 mol H2和2 mol NH3达到平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x=________,y=________。平衡时H2的物质的量________(选填一个编号)。
A.大于6 mol B.等于6 mol
C.小于6 mol D.可能大于、小于或等于6 mol
作出判断的理由是______________________________________________。
(4)若在(3)的平衡混合物中,再加入6 mol NH3,再次达到平衡后,NH3的质量分数为________。
解析: N2(g) + 3H2(g)  2NH3(g)
2NH3(g)
n(开始) 1 mol 3 mol 0
n(转化) mol a mol a mol
n(平衡) 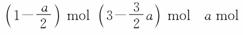
恒温、恒压下,将起始物质转化为方程式同一侧时,物质的量之比相同,即建立等效平衡。故(2)、(3)、(4)均与(1)是等效平衡,达到平衡时NH3的质量分数相同。
答案:(1) (2)3 9 (3)2 3- D
若3a>2,则平衡时H2的物质的量小于6 mol,若3a=2,则平衡时H2的物质的量等于6 mol,若3a<2,则平衡时H2的物质的量大于6 mol(其他合理理由也可) (4)50a%
15. 在实验室进行工业合成氨的模拟实验:
N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
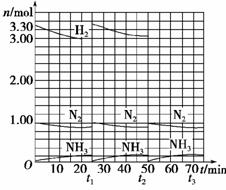
当反应达到平衡后,分离出氨,并补充氮气、氢气物质的量之比与起始时相同的原料气,以实现连续生产,各组分物质的量和时间的关系如下图所示。

(1)起始时刻氮气与氢气的物质的量之比n(N2)∶n(H2)=________。反应开始至15 min时第一次达到平衡,容器体积为1 L,这段时间内,以NH3的浓度变化表示的平均反应速率是________。
(2)写出代表H2的曲线在下列时刻的坐标并在图上画出t1-t2间的曲线:
t1补充原料气之后:(________,________);t2处于平衡状态时:(________,________)。
(3)第一次达平衡时H2的转化率是________。
以t1补充原料气之后为起始状态,第二次达到平衡时H2的转化率是________。
以这样的氮气和氢气的物质的量之比补充原料气,试计算经济上是否合算?
解析:(1)观察图像的起点,氮气为1.00 mol,氢气为3.30 mol,其比值为:1∶3.3;纵坐标每小格为0.20 mol,则v(NH3)=0.20 mol/(1 L×15 min)=0.013 3 mol/(L·min)。
(2)第一次平衡时,氮气的物质的量为0.90 mol,在t1时,加入氮气应为0.10 mol,再根据“补充氮气、氢气物质的量之比与起始时相同的原料气”,可求出应加入的氢气的物质的量为:0.10 mol×3.3=0.33 mol,而第一次平衡时,氢气为3.00 mol,故t1补充原料气之后的坐标为(25,3.33);第二次平衡时,生成氨气仍为0.20 mol,消耗的氢气为0.30 mol、氮气为0.10 mol,故平衡气体中,氢气的物质的量为(3.33-0.30) mol,t2处于平衡状态时的坐标为(50,3.03)。
(3)第一次平衡时氢气的转化率为:(0.30 mol/3.30 mol)×100%=9.09%;
第二次平衡时氢气的转化率为:(0.30 mol/3.33 mol)×100%=9.01%;第二次的转化率低,不合算。
答案:(1)1∶3.3 0.013 3 mol/(L·min)
(2)(25,3.33) (50,3.03)(右图)
(3)9.09% 9.01% 不合算
14.反应:PCl5(g)  PCl3(g)+Cl2(g)①
PCl3(g)+Cl2(g)①
2HI(g)  H2(g)+I2(g)②
H2(g)+I2(g)②
2NO2(g)  N2O4(g)③
N2O4(g)③
在一定条件下,达到化学平衡时,反应物的转化率均是 a%。若保持各反应的温度和容器的体积都不改变,分别再加入一定量的各自的反应物,则转化率( )
A.均不变 B.①增大,②不变,③减少
C.均增大 D.①减少,②不变,③增大
解析:对于可逆反应:aA(g)bB(g)+cC(g),增加A的量,平衡向正方向移动,但该反应物A的转化率的变化与方程式中气体的系数有关:Ⅰ.若a=b+c,A的转化率不变,如题给反应②;Ⅱ.若a>b+c,A的转化率增大,相当于题给反应③,Ⅲ.若a<b+c,A的转化率减小,相当于反应①。本题也可这样理解:在恒温恒容条件下,对反应物只有一种的可逆反应来说,增大反应物浓度,同时反应体系的压强也增大了(这是一个隐含条件),讨论如下:①若压强增大能使平衡移动,且移动方向与增大反应物浓度使平衡移动方向一致,则反应物转化率增大,若方向不一致,则反应物转化率减小。②若压强增大不能使平衡移动,则反应物的转化率不变。再结合题目的反应即可判断。
答案:D
13.
可逆反应A(g)+B C(g)+D达到平衡时,下列说法不正确的是( )
C(g)+D达到平衡时,下列说法不正确的是( )
A.若增大A的浓度,平衡体系颜色加深,D不一定是具有颜色的气体
B.增大压强,平衡不移动,说明B、D必是气体
C.升高温度,C的百分含量减小,说明正反应是放热反应
D.若B是气体,增大A的浓度会使B的转化率增大
解析:增大压强,平衡不移动,B、D既可以都是气体,也可以都不是气体。
答案:B
12.如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2
mol A和1 mol B,乙中充入2
mol C和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)  2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是( )
2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是( )

A.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
B.达到平衡后,隔板K最终停留在左侧刻度0-2之间
C.达到平衡时,甲容器中C的物质的量大于乙容器中C的物质的量
D.若平衡时K停留在左侧1处,则活塞仍停留在右侧6处
解析:由题意可知:2A(g)+B(g)  2C(g),由于甲中充入2 mol A和1 mol B,反应向正反应方向进行,甲中压强降低,所以活塞向甲容器中移动,最多能转化为2 mol C。由于是可逆反应,C的物质的量在0-2 mol之间,达到平衡后,隔板K不再滑动,最终停留在左侧刻度0-2之间。如果不充入He,甲、乙两容器为等效平衡,都相当于2 mol C。又因为保持恒压的条件,充入He,那么乙中2A(g)+B(g)2C(g)反应体系相当于压强降低,所以到达平衡时,乙向逆方向反应的程度大于甲中,导致到达平衡时甲容器中C的物质的量大于乙容器中C的物质的量。甲、乙容器中压强相等,若平衡时K停留在左侧1处,则活塞停留在6处右侧。D错误。
2C(g),由于甲中充入2 mol A和1 mol B,反应向正反应方向进行,甲中压强降低,所以活塞向甲容器中移动,最多能转化为2 mol C。由于是可逆反应,C的物质的量在0-2 mol之间,达到平衡后,隔板K不再滑动,最终停留在左侧刻度0-2之间。如果不充入He,甲、乙两容器为等效平衡,都相当于2 mol C。又因为保持恒压的条件,充入He,那么乙中2A(g)+B(g)2C(g)反应体系相当于压强降低,所以到达平衡时,乙向逆方向反应的程度大于甲中,导致到达平衡时甲容器中C的物质的量大于乙容器中C的物质的量。甲、乙容器中压强相等,若平衡时K停留在左侧1处,则活塞停留在6处右侧。D错误。
答案:D
11.(2008·海南,10)X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
A.33% B.40% C.50% D.65%
解析:设X、Y的初始物质的量均为1 mol,转化的物质的量分别为a mol、2a mol、2a mol,由方程式
X + 2Y 2Z
2Z
开始(mol) 1 1 0
转化(mol) a 2a 2a
平衡(mol) 1-a 1-2a 2a
由题意得=,求得:a=,因此Y的转化率为×100%,最接近65%。
答案:D
10.对于平衡体系:mA(g)+nB(g)  pC(g)+qD(g),下列判断正确的是( )
pC(g)+qD(g),下列判断正确的是( )
A.若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.45倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若升高平衡体系的温度,达到新平衡时A的浓度变为原来的0.55倍,说明该反应ΔH<0
D.若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定等于原体积的
解析:将容器的容积增大1倍,A的浓度应变为原来的0.5 倍,现A的浓度变为原来的0.45倍,故减小压强平衡向正反应方向移动,A项错;升高温度,达到新平衡时A的浓度变为原来的0.55倍,故升高温度平衡向正反应方向移动,C项错;增大压强平衡向体积减小的方向移动,达到新平衡时,总体积小于原体积的,若m+n=p+q,D项才能符合题意,D项错。
答案:B
9.
对可逆反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3)∶n(O2)=4∶5
B.反应达到平衡后,对体系一直进行加压,平衡总是向逆向移动
C.反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动
D.当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡
解析:平衡时,反应物的转化率相等,则起始投入量之比应该等于化学计量数之比,故A正确;当加压到一定压强时,气态水变为非气态水,平衡会向正向移动,故B错;充入稀有气体而压强不变,相当于增大容积,平衡向体积增大的方向移动,C错;NH3、NO的正反应速率都是向右方向的速率,平衡与否其反应速率之比都等于化学计量数之比,故D错。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com