
题目列表(包括答案和解析)
6.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
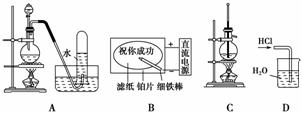
A.二氧化锰与浓盐酸反应制干燥氯气
B.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用外加保护膜的细铁棒做笔在滤纸上写字显红色字迹
C.石油的分馏
D.用水吸收氯化氢气体
解析:用排水法收集Cl2,得不到干燥氯气,故A选项不正确;细铁棒接电源负极,作阴极产生H2,阴极附近OH-的浓度增大,遇酚酞变红色,故B选项正确;石油分馏温度计的水银球应在支管口附近,故C选项错误;HCl极易溶于水,用此装置会引起倒吸,不安全,故D选项错误。
答案:B
5.某学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失。下列叙述中该同学对实验原理的解释和所得结论不正确的是( )
A. 氧化性:HClO>I2>SO
B.蓝色消失的原因是Na2SO3溶液具有漂白性
C.淀粉KI溶液变蓝是因为I-被HClO氧化为I2,I2遇淀粉变蓝
D.若将Na2SO3溶液加入氯水中,氯水退色
解析:SO具有强还原性,可被HClO和I2氧化。第二步溶液蓝色消失是SO还原I2的结果。
答案:B
4.下列对有关化学反应过程或实验现象的解释正确的是( )
A.Cl2的水溶液可以导电,说明Cl2是电解质
B.在高温条件下,C能置换出SiO2中的Si,说明C的氧化性强于Si
C.向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2
D.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后,溶液退色,
说明BaCl2溶液有酸性
解析:电解质属于化合物,不是单质,A错;在高温条件下,C能置换出SiO2中的Si,说明在高温条件下C的还原性强于Si,B错;向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色说明有碘生成,说明Cl2的氧化性强于I2,C正确;在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后,生成BaCO3沉淀,发生复分解反应,导致CO的水解向逆方向进行,所以溶液退色,BaCl2溶液呈中性,因果关系不对应,D错。
答案:C
3. 漂白粉在空气中放置易失效的主要原因是( )
A.Ca(ClO)2不稳定,易分解 B.Ca(ClO)2易吸收水分而潮解
C.Ca(ClO)2跟空气中的水和CO2反应 D.Ca(ClO)2跟空气中的CO2反应
解析:漂白粉在空气中放置易失效的主要原因是碳酸可以与Ca(ClO)2反应生成HClO,次氯酸不稳定,在光的作用下易分解,使漂白粉失效。发生的化学方程式为:
Ca(ClO)2+CO2+H2O===CaCO3+2HClO,2HClO2HCl+O2↑。
答案:C
2.氯气性质活泼,下列物质不能由氯气和单质直接化合得到的是( )
A.NaCl B.FeCl2 C.FeCl3 D.CuCl2
解析:氯气与变价金属单质直接化合时得高价氯化物。
答案:B
1.(2009·台湾,62)下列三个反应式中的X与Y分别为两种金属元素的代号,但Cl为氯的元素符号。
X+YCl2===XCl2+Y
Cl2+2XCl2===2XCl3
Y+2XCl3===YCl2+2XCl2
已知三个反应均能向右进行,试依据以上三个反应式,推测下列物质中哪一个是最强的氧化剂( )
A.XCl3 B.XCl2 C.Cl2 D.Y E.YCl2
解析:氧化还原反应遵循方向为:强氧化剂+强还原剂―→弱氧化剂+弱还原剂,在同一氧化还原反应中,氧化剂的氧化性要强于氧化产物的氧化性,
X + YCl2 ―→ XCl2 + Y 氧化剂强弱:YCl2>XCl2,
还原剂 氧化剂 氧化产物 还原产物
Cl2 + 2XCl2 ―→ 2XCl3 氧化剂强弱:Cl2>XCl3
氧化剂 还原剂 氧化产物、还原产物
Y + 2XCl3 ―→ YCl2 + 2XCl2 氧化剂强弱:XCl3>YCl2
还原剂 氧化剂 氧化产物 还原产物
所以氧化性强弱顺序:Cl2>XCl3>YCl2>XCl2。
答案:C
20.人们利用各种月球探测器从月球带回的样品研究发现:

月球上重要岩石之一--月海玄武岩,它富含铁和钛,填充了广阔的月海洼地。月海玄武岩中的铁钛矿不仅是铁、钛和氧的主要资源,而且钛铁矿与氢气反应能产生水(FeTiO3+H2―→Fe+TiO2+H2O),生成的TiO2经下列转化可制取重要金属Ti:TiO2―→TiCl4
据此回答下列问题:
(1)在钛铁矿与氢气反应中,还原产物是 。
(2)反应TiCl4+2Mg800℃Ar2MgCl2+Ti在Ar气氛围中进行的理由是 。
(3)TiO2与氯气反应生成TiCl4和另一种单质气体的化学方程式为 。
解析:(1)在钛铁矿与氢气的反应中,铁的化合价由+2―→0,化合价降低,铁元素被还原,得到铁。
(2)Mg是活泼金属易与空气中的O2、CO2、N2反应,故应在稀有气体氛围中进行。
(3)TiO2转化为TiCl4,钛元素的化合价未变,因此氧元素化合价升高,生成氧气。
答案:(1)Fe (2)防止高温下Mg(Ti)与空气中的O2(或CO2、N2)反应 (3)TiO2+2Cl2===TiCl4+O2
19.NaBH4(硼氢化钠)是典型的离子化合物,在有机反应中可将醛、酮变为醇。
(1)硼氢化钠极易溶于水,并与水反应产生氢气,反应后以BO(弱酸HBO2的酸根)存在,试写出反应的离子方程式 ,
该反应中氧化剂是 ,还原剂是 。
(2)溶液的酸性对硼氢化钠与水的反应速率有影响,酸性越强,其反应速率越 ,这是因为 。
(3)硼氢化钠能把许多金属离子还原为金属单质,为抑制它与水的反应,反应在A__(填“酸性”“中性”或“碱性”)条件下进行,试写出金离子(Au3+)被硼氢化钠还原的离子方程式 。
解析:该题是综合性题,它考查离子方程式的书写,氧化剂、还原剂的判断等内容。(1)根据题意,可知NaBH4有极强的还原性,可与溶液中的大多数阳离子反应;(2)和(3)可从H+浓度的大小角度入手解题。
答案:(1)BH+2H2O===BO+4H2↑ H2O BH (2)快 H+与BO结合生成弱电解质HBO2,减小了BO浓度,使反应速率加快或BO水解使溶液呈碱性,加酸能促进BO的水解,减小BO浓度,故反应速率加快 (3)碱性 8Au3++3BH+24OH-===8Au↓+3BO+18H2O
18. 下表是某食用碘盐包装袋上的部分说明:
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量 |
35±15 mg/kg |
|
储藏方法 |
密封、避光、防潮 |
|
食用方法 |
烹饪时,待食品熟后加入碘盐 |
(1)下列说法正确的是( )
A.高温会导致碘的损失 B.碘酸钾可氧化氯化钠
C.只用淀粉就能检验碘盐中的碘酸钾 D.该碘盐中碘酸钾含量为20-50 mg/kg
(2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI+3H2OKIO3+3H2↑。则阳极电极反应式为。
(3)已知:I2+2S2O===2I-+S4O。某学生测定食用碘盐中碘的含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全。
则所测盐中碘的含量是(以含w的代数式表示) mg/kg。
解析:(1)高温会导致碘酸钾分解;氯化钠性质稳定,不可能被碘酸钾氧化;表中标明的是碘含量而不是碘酸钾含量。(2)阳极发生失电子反应,I-有还原性,容易失电子。(3)根据I2+2S2O===2I-+S4O,KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O,n(Na2S2O3)=2.0×10-3×0.01=2.0×10-5(mol),n(I2)=1.0×10-5 mol,n(KIO3)=1/3×1.0×10-5 mol,n(I)=1/3×1.0×10-5 mol,m(I)=1/3×1.0×10-5×127×1 000=4.2×10-1(mg)。碘的含量是(以含w的代数式表示)4.2×102/w mg/kg。
答案:(1)A (2)I--6e-+3H2O―→IO+6H+ (3)4.2×102/w[或1 270/(3w)或423/w]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com