
题目列表(包括答案和解析)
6.(2009·安徽理综,26)  是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
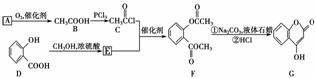
(1)A与银氨溶液反应有银镜生成,则A的结构简式是________。
(2)B―→C的反应类型是________。
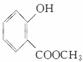
(3)E的结构简式是________。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:________________________________________________________________________。
(5)下列关于G的说法正确的是________。
a.能与溴单质反应 b.能与金属钠反应
c.1 mol G最多能和3 mol氢气反应 d.分子式是C9H6O3
解析:(1)A催化氧化得乙酸,且A能发生银镜反应,所以A是乙醛,结构简式:CH3CHO。
(2)羧基中的-OH在PCl3存在条件下被Cl原子取代。
 (4)F在强碱性条件下水解,生成二种钠盐和甲醇等。
(4)F在强碱性条件下水解,生成二种钠盐和甲醇等。
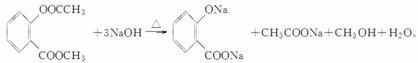 (5)G结构中含苯环、酯基、醇羟基以及碳碳双键,能与Br2发生加成反应或取代反应,与金属钠发生反应生成氢气,1 mol G中含有1 mol碳碳双键和1 mol苯环,可与4 mol H2加成;分子式C9H6O3。正确选项有a、b、d。
(5)G结构中含苯环、酯基、醇羟基以及碳碳双键,能与Br2发生加成反应或取代反应,与金属钠发生反应生成氢气,1 mol G中含有1 mol碳碳双键和1 mol苯环,可与4 mol H2加成;分子式C9H6O3。正确选项有a、b、d。
答案:(1)CH3CHO (2)取代反应 (3)
(4) 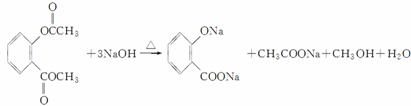 (5)a、b、d
(5)a、b、d
5.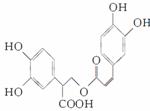 (2009·上海单科,9)迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如下图。下列叙述正确的是( )
(2009·上海单科,9)迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如下图。下列叙述正确的是( )
A.迷迭香酸属于芳香烃
B.1 mol迷迭香酸最多能和9 mol氢气发生加成反应
C.迷迭香酸可以发生水解反应、取代反应和酯化反应
D.1 mol迷迭香酸最多能和含5 mol NaOH的水溶液完全反应
解析:A项,该物质分子中含氧元素,不属于烃类;B项,该物质1个分子中有2个苯环和1个碳碳双键,故1 mol迷迭香酸最多和7 mol氢气发生加成反应;C项,分子中有酯基,可发生水解反应;有羧基可发生酯化反应;有酚羟基,其邻、对位上的氢原子可发生取代反应,C项正确;D项,分子中有4 mol酚羟基和1 mol羧基,共消耗5 mol NaOH;还有1 mol酯基水解后生成的羧基又消耗1 mol NaOH,故1 mol该物质最多消耗6 mol NaOH。
答案:C
4. (2009·全国Ⅰ理综,12)有关下图所示化合物的说法不正确的是( )

A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B.1 mol该化合物最多可以与3 mol NaOH反应
C.既可以催化加氢,又可以使酸性KMnO4溶液退色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
解析:该有机物中含有碳碳双键、甲基等基团,故与Br2既可以发生加成反应又可以在光照下发生取代反应;酚羟基消耗1 mol NaOH,两个酯基消耗2 mol NaOH;碳碳双键及苯环都可以和氢气加成,碳碳双键可以使KMnO4(H+)溶液退色;该有机物中不存在羧基,故不能与NaHCO3反应。
答案:D
3.(2009·江苏单科,10)具有显著抗癌活性的10羟基喜树碱的结构如图所示。下列关于10羟基喜树碱的说法正确的是( )

A.分子式为C20H16N2O5
B.不能与FeCl3溶液发生显色反应
C.不能发生酯化反应
D.一定条件下,1 mol该物质最多可与1 mol NaOH反应
解析:A项正确;B项,图中有酚的结构,可与Fe3+发生显色反应;C项,图中有-OH,可发生酯化反应;D项,图中有酯、酚结构,最多可与2 mol NaOH反应。
答案:A
2.下列物质中,在一定条件下既能发生银镜反应又能发生水解反应的是( )
A.CH2CH2OOCHOH B.蔗糖
C.果糖 D.麦芽糖
解析:B项不能发生银镜反应,C项既不能发生银镜反应也不能水解。
答案:AD
1.某有机物和足量的银氨溶液在微热条件下发生银镜反应,生成10.8 g银,而燃烧等量的有机物时,需消耗氧气6.16 L(标准状况),该有机物是( )
A.葡萄糖 B.甲酸乙酯 C.丁醛 D.乙醛
解析:含醛基的物质与银氨溶液反应,R-CHO+2Ag(NH3)2OH△水溶RCOONH4+2Ag↓+3NH3+H2O,由方程式可知含有一个醛基的物质与银氨溶液反应时两者物质的量之比为1∶2。
n(Ag)==0.1 mol
n(有机物)==0.05 mol
n(O2)==0.275 mol。
根据每1 mol C原子消耗1 mol O2生成1 mol CO2,每4 mol H原子消耗1 mol O2生成2 mol H2O,对四个选项的分子式进行变形,再分别计算。
选项A,C6H12O6可写成C6(H2O)6,需O26×0.05 mol=0.3 mol
选项B,C3H6O2可写成C3H2(H2O)2,需O2×0.05 mol=0.175 mol
选项C,C4H8O可写成C4H6(H2O),需O2×0.05 mol=0.275 mol
选项D,C2H4O可写成C2H2(H2O),需O2×0.05 mol=0.125 mol。
答案:C
[设计与实施方案](1)取步骤③所得的溶液少许,于一支洁净试管中,滴加KSCN溶液,如溶液不显血红色,再向溶液中滴加少量氯水,溶液显血红色,证明原溶液中只含有Fe2+ (2)过量 防止未反应的铁与硫酸反应,生成亚铁离子干扰实验 (3)防止氧气参与反应 (4)铁和硫的反应是放热反应 (5) 除去过量的硫粉 3S+6OH-2S2-+SO+3H2O (6)③ 为了防止溶液中的氧气氧化亚铁离子 在滤渣中加入煮沸的稀H2SO4
18.在通常状况下,A为固态单质。根据下图转化关系,回答:
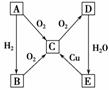
(1)写出A、C、E的化学式:
A__________,C__________,E__________。
(2)写出下列反应的化学方程式:
①E―→C________________________________________________________________;
②C―→D________________________________________________________________。
(3)B与D的浓溶液____________发生反应(填“能”或“不能”),若能反应,则反应的化学方程式为________,反应现象为_________________________________________。
(4)将C通入BaCl2溶液中,没有明显现象,但若加入H2O2,则有白色沉淀生成,请分析其原因________________,并写出有关的化学方程式________________________________________________________________________。
思路分析:以ACDE为解题突破口,A为固态单质,B为A元素的氢化物,C为A元素的氧化物,再结合图示中的各转化关系做出推断。
解析:因A为固态单质,则B为其氢化物,C为其氧化物,故A为固态非金属单质。由ACDE,知E为能与Cu反应的酸(浓H2SO4或HNO3),由A为固态单质,推断A为S,B为H2S,C为SO2,D为SO3,E为H2SO4,D的浓溶液即浓H2SO4,与H2S易发生氧化还原反应,可生成单质S和SO2使溶液变浑浊,产生有刺激性气味的气体。H2O2有强氧化性,根据题意能把+4价硫(SO2)氧化为+6价硫(H2SO4),按要求写出相关化学方程式即可。
答案:(1)S SO2 H2SO4 (2)①Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
②2SO2+O2 2SO3 (3)能 H2S+H2SO4(浓)===S↓+SO2↑+2H2O
2SO3 (3)能 H2S+H2SO4(浓)===S↓+SO2↑+2H2O
溶液变浑浊,有刺激性气味的气体放出 (4)H2O2具有强氧化性,能把SO2氧化为H2SO4 H2O2+SO2===H2SO4;H2SO4+BaCl2===BaSO4↓+2HCl
设计和实施方案:①将铁粉和硫粉按一定质量比混合,在惰性气体环境中,用烧热的玻璃棒点触混合粉末,反应即可发生并持续进行,冷却后得到黑色固体;
②取黑色固体少许,加入浓NaOH溶液并稍稍加热,冷却后过滤,得到黑色滤渣;
③在滤渣中加入稀硫酸得到溶液;
④________________________________________________________________________。
请回答下列问题:
(1)简要写出步骤④的实验操作、现象和结论___________________________________。
(2)铁粉和硫粉的混合粉末中,硫粉的量应________(填“过量”或“少量”),其原因是________________________________________________________________________
________________________________________________________________________。
(3)反应在惰性气体环境中进行的原因_________________________________________。
(4)用烧热的玻璃棒点触混合粉末,反应即可发生并持续进行,原因是_______________。
(5)步骤②中加入浓NaOH溶液并稍稍加热的目的是________________________________________________________________________,
反应的离子方程式为___________________________________________________。
(6)你认为上述实验步骤中还需改进的是________(填上述的步骤序号);改进的理由________________________________________________________________________;
改进后的步骤为______________________________________________________。
解析:铁与硫的反应为Fe+SFeS;若反应过程中有氧气参与,就可能生成+3价的铁,所以探究实验关键的操作就是避开O2参与,包括溶液中的反应。
答案:[猜想与假设](二)+3
23.测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol/L的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式________________________________________________________________________。
(2)判断滴定终点的方法是________________________________________________________________________。
(3)计算:血液中含钙离子的浓度为________g·mL-1。
解析:因为KMnO4溶液至反应完毕过量时,会使溶液呈紫色,故可用滴入一滴酸性KMnO4溶液由无色变为浅紫色且半分钟不退色的方法来判断终点。由题意知可能发生反应的离子方程式为:2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O、Ca2++C2O===CaC2O4↓、CaC2O4+2H+===Ca2++H2C2O4。
设2 mL血液中含Ca2+的物质的量为x,则
5Ca2+-5CaC2O4-5H2C2O4-2MnO
5 2
x 20.0×10-3 L×1.0×10-4 mol/L
x=5.0×10-6 mol,1 mL血液中Ca2+的浓度为
=1.0×10-4 g·mL-1。
答案:(1)2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O (2)当滴入1滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不退色 (3)1.0×10-4
22. 常温下,pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显酸性;0.01 mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显中性。
请回答下列问题:
(1)高碘酸是________(填“强酸”或“弱酸”),理由是________________________________________________________________________。
(2)0.01 mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合所得溶液中IO与Na+的浓度关系是________(填“大于”、“小于”或“等于”)。
(3)已知高碘酸和硫酸锰在溶液中反应生成高锰酸、碘酸和硫酸,此反应中的还原剂是__________(写化学式),该反应的离子方程式为________________________________________________________________________。
解析:pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显酸性,则高碘酸必定是不完全电离,可推知高碘酸是弱酸;同理可推出碘酸(HIO3)和高锰酸为强酸,等物质的量反应后,IO与Na+的浓度相等。
答案:(1)弱酸 pH=2的高碘酸电离出的c(H+)和pH=2的NaOH溶液电离出的c(OH-)相等,且两者体积相等,但所得溶液显酸性,则高碘酸必定是不完全电离,所以高碘酸是弱酸 (2)等于 (3)MnSO4 2Mn2++5HIO4+3H2O===2MnO+5IO+11H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com