
题目列表(包括答案和解析)
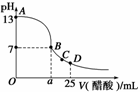
21.在25 mL氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示。
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式:
________________________________________________________________________。
(2)该氢氧化钠溶液的物质的量浓度为______mol/L。
(3)在B点,a______12.5 mL(填“>”、“<”或“=”,下同)。若由体积相等的氢氧化钠和醋酸溶液混合而恰好呈中性,则混合前c(NaOH)________c(CH3COOH),混合前酸中
c(H+)和碱中c(OH-)的关系:c(H+)______c(OH-)。
(4)在D点,溶液中离子浓度大小关系为:________________________________________________________________________。
解析:(2)由图像知,当不加醋酸时,pH=13,则氢氧化钠溶液的物质的量浓度为0.1 mol/L;(3)由图像知,B点pH=7,若a=12.5 mL,则酸碱恰好完全反应,则生成了强碱弱酸盐,溶液呈碱性,故若要pH=7,醋酸要过量,即a>12.5 mL。若体积相等混合呈中性,氢氧化钠浓度应小于醋酸浓度。由于酸是弱酸,碱是强碱,故混合前c(H+)<c(OH-)。(4)在D点,醋酸过量,溶液呈酸性,即c(H+)>c(OH-),又由电荷守恒,c(CH3COO-)+c(OH-)=
c(Na+)+c(H+),所以各种离子浓度大小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
答案:(1)OH-+CH3COOH===CH3COO-+H2O (2)0.1 (3)> < <
(4)c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
20.三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3·6H2O晶体。填写下列空白:
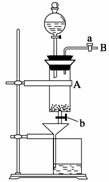
(1)收集B处的气体可采用的方法是________________________________________________________________________。
(2)滴加盐酸时,发现反应速率较盐酸与纯铁粉反应的要快,其原因是________________________________________________________________________。
(3)烧杯内盛放过量稀HNO3的原因是________________________________________________________________________,
反应的离子方程式是________________________________________________________________________。
(4)整个实验过程中,旋塞a都必须打开,除了为排出产生的气体外,另一个目的是________________________________________________________________________。
(5)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3·6H2O,而不用直接蒸干的方法来制得晶体的理由是________________________________________________________________________。
解析:(1)从导管B处排出的气体是H2,可用向下排空气法或排水集气法收集。
(2)废铁屑中含有少量铜,Fe-Cu-稀盐酸三者构成原电池,加快了反应速率。
(3)Fe与盐酸反应产生的FeCl2溶液经过滤装置进入稀HNO3中,HNO3将Fe2+氧化成Fe3+,反应的离子方程式为:3Fe2++4H++NO===3Fe3++NO↑+2H2O
(4)实验时旋塞a必须打开,是使容器A中的压强和外界气压相等,便于装置A中的液体顺利流下。
(5)因FeCl3+3H2OFe(OH)3+3HCl,若将溶液直接蒸干,HCl挥发,上述平衡向正反应方向移动,FeCl3水解,则得不到三氯化铁晶体,故采用蒸发、浓缩、再降温结晶的方法制得FeCl3·6H2O。
答案:(1)排水集气法或向下排空气法
(2)废铁屑中有Cu杂质,形成了铜、铁原电池
(3)确保所有的Fe2+转化为Fe3+
3Fe2++4H++NO===3Fe3++NO↑+2H2O
(4)与大气相通,保证装置A中的液体顺利流下,便于过滤操作的顺利进行
(5)防止加热时FeCl3水解而得不到FeCl3·6H2O
19. 许多在水溶液中的反应,往往有易溶物转化为难溶物或难溶物转化为更难溶物的现象。下表为相同温度下某些物质的溶解度。
|
物质 |
AgCl |
Ag2S |
CaSO4 |
Ca(OH)2 |
|
溶解度/g |
1.5×10-4 |
1.3×10-6 |
0.2 |
0.165 |
|
物质 |
Ca(HCO3)2 |
CaCO3 |
NH4HCO3 |
(NH4)2SO4 |
|
溶解度/g |
16.6 |
1.5×10-3 |
21 |
75.4 |
(1)若在有氯化银固体的水中加入硫化钠溶液,可能发生的现象是________________________________________________________________________。
(2)生成硫酸铵化肥的方法之一是:把石膏粉(CaSO4)悬浮于水中,不断通入氨气并通入适量的二氧化碳,充分反应后立即过滤,滤液经蒸发而得到硫酸铵晶体,写出该反应的化学方程式________________________________________________________________________。
解析:(1)通过简单计算,可知Ag2S更难溶,因此AgCl可以转化为Ag2S,白色沉淀消失,同时会生成黑色的Ag2S沉淀。
(2)由于NH3溶于水显碱性,而CO2溶于水显酸性(注意:必须先通NH3后通CO2),两者生成NH、CO,Ca2+与CO结合生成溶解度更小的CaCO3沉淀,所以SO和NH会生成(NH4)2SO4。
答案:(1)白色固体消失,同时会生成黑色固体
(2)CaSO4+CO2+H2O+2NH3===CaCO3↓+(NH4)2SO4
18.已知难溶电解质在水溶液中存在溶解平衡:
MmAn(s) 
 mMn+(aq)+nAm-(aq),Ksp=[Mn+]·[Am-]n,称为溶度积。
mMn+(aq)+nAm-(aq),Ksp=[Mn+]·[Am-]n,称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
|
难溶电解质 |
CaCO3 |
CaSO4 |
MgCO3 |
Mg(OH)2 |
|
Ksp |
2.8×10-9 |
9.1×10-6 |
6.8×10-6 |
1.8×10-11 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④________________________________________________________________________。
(1)由题中信息Ksp越大,表示电解质的溶解度越______(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:________________________________________________________________________。
(3)设计第③步的目的是________________________________________________________________________。
(4)请补充第④步操作及发生的现象:________________________________________________________________________。
解析:本题考查的知识点为教材新增加的内容,题目在设计方式上为探究性实验,既注重基础知识,基本技能的考查,又注重了探究能力的考查。由Ksp表达式不难看出其与溶解度的关系,在硫酸钙的悬浊液中存在着:CaSO4(s) 
 SO(aq)+Ca2+(aq),而加入Na2CO3后,溶液中CO浓度较大,而CaCO3的Ksp较小,故CO与Ca2+结合生成沉淀,即CO+Ca2+===CaCO3↓。既然是探究性实验,必须验证所推测结果的正确性,故设计了③④步操作,即验证所得固体是否为碳酸钙。
SO(aq)+Ca2+(aq),而加入Na2CO3后,溶液中CO浓度较大,而CaCO3的Ksp较小,故CO与Ca2+结合生成沉淀,即CO+Ca2+===CaCO3↓。既然是探究性实验,必须验证所推测结果的正确性,故设计了③④步操作,即验证所得固体是否为碳酸钙。
答案:(1)大 (2)Na2CO3+CaSO4===Na2SO4+CaCO3 (3)洗去沉淀中附着的SO (4)向沉淀中加入足量的盐酸,沉淀完全溶解
17.将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为( )
A.只有AgBr沉淀生成
B.AgCl和AgBr沉淀等量生成
C.AgCl和AgBr沉淀都有,但以AgCl沉淀为主
D.AgCl和AgBr沉淀都有,但以AgBr沉淀为主
解析:在AgCl和AgBr的饱和溶液中存在:
AgCl(s) 
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
AgBr(s) 
 Ag+(aq)+Br-(aq)
Ag+(aq)+Br-(aq)
当加入浓AgNO3溶液时,上述平衡均向左移动,由于AgBr的溶解度小于AgCl的溶解度,原溶液中Cl-浓度大,故AgCl沉淀生成的多。
答案:C
16.在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s)
 Ca(OH)2(aq)
Ca(OH)2(aq) 
 Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是( )
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是( )
A.n(Ca2+)增大 B.c(Ca2+)不变 C.n(OH-)增大 D.c(OH-)增大
解析:当向悬浊液中加入少量生石灰时,会发生:CaO+H2O===Ca(OH)2,原饱和溶液中溶剂H2O减少,Ca(OH)2会有部分从溶液中析出形成沉淀,故n[Ca(OH)2]减少,A、C错误,但在一定温度下Ca(OH)2的溶解度不变,其浓度不变,故B正确。
答案:B
15.往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。则原溶液中c(I-)/c(Cl-)的比值为( )
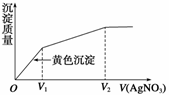
A.(V2-V1)/V1 B.V1/V2
C.V1/(V2-V1) D.V2/V1
解析:从图像变化情况看,O―→V1主要是生成AgI沉淀,V1―→V2段主要是生成AgCl沉淀,所以溶液中c(I-)/c(Cl-)=。
答案:C
14. 有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去盐酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
解析:Ba(OH)2、NaOH为强碱,pH相同即c(OH-)相同耗用等体积的盐酸,NH3·H2O为弱碱,中和时会继续电离消耗盐酸多。
答案:C
13.在BaSO4饱和溶液中,加入Na2SO4(s),达平衡时( )
A.c(Ba2+)=c(SO)
B.c(Ba2+)=c(SO)=[Ksp(BaSO4)]1/2
C.c(Ba2+)≠c(SO),c(Ba2+)·c(SO)=Ksp(BaSO4)
D.c(Ba2+)≠c(SO),c(Ba2+)·c(SO)≠Ksp(BaSO4)
解析:BaSO4饱和溶液中存在溶解平衡,c(Ba2+)=c(SO)且c(Ba2+)·c(SO)=Ksp(BaSO4)。加入Na2SO4(s),Na2SO4溶于水中电离出SO使c(SO)增大,溶解平衡逆向移动,使
c(Ba2+)减小,但达到平衡时离子积不变,仍然有c(Ba2+)·c(SO)=Ksp(BaSO4)。
答案:C
12.室温下,在pH=11的某溶液中,由水电离的c(OH-)可能为( )
①1.0×10-7 mol·L-1 ②1.0×10-6 mol·L-1
③1.0×10-3 mol·L-1 ④1.0×10-11 mol·L-1
A.③ B.④ C.①③ D.③④
解析:pH=11即c(OH-)=10-3 mol·L-1是碱性溶液,碱性溶液有两种情况:一是碱溶液,一是强碱弱酸盐的溶液。解此题要注意一个关键问题,由水电离出的c(H+)始终等于由水电离出的c(OH-)。若为碱溶液,由水电离出的c(OH-)=c(H+)==10-11 mol·L-1;
若为强碱弱酸盐的溶液,由水电离出的c(OH-)=10-3 mol·L-1。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com