
题目列表(包括答案和解析)
16.在某无色溶液里,只含有下列8种离子中的某几种:Na+、H+、Ag+、Mg2+、Cl-、OH-、HCO、NO。已知该溶液能跟铝粉反应,且放出的气体只有H2。试回答:
(1)若溶液和铝粉反应后有[Al(OH)4]-生成,则溶液中一定含有大量的 离子,
还可能含有大量的 离子。
(2)若溶液和铝粉反应后有Al3+生成,则原溶液中一定不含有大量的 离子。
解析:(1)溶液与铝粉反应生成[Al(OH)4]-,则溶液一定含有大量的OH-,所给离子中可与OH-大量共存的有Na+、Cl-和NO,但溶液中必须有阳离子存在,故Na+一定大量存在。
(2)溶液与铝粉反应产生Al3+,则溶液中一定含有大量的H+。与H+大量共存的离子有Na+、Mg2+、Cl-、NO,但因NO在酸性条件下有强氧化性,与金属反应不产生H2,故阴离子只能是Cl-。Ag+与Cl-不能大量共存,故溶液中一定不含有OH-、HCO、NO、Ag+。
答案:(1)OH-、Na+ Cl-、NO (2)OH-、HCO、NO、Ag+
15.(原创)近年来,太湖蓝藻暴发,造成无锡市自来水水源地水质的严重恶化。这次事件再次敲响了我国水危机的警钟。太湖流域某化工厂排放的污水中,常溶有某些对人体有害的物质,初步认为可能含有Fe3+、Ba2+、K+、OH-、Cl-、CO、SO。为了进一步确认,取样进行实验检测:
①取污水仔细观察,呈无色、透明、均一状态。
②向取样的污水中,滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白色沉淀不消失。
③用pH试纸测定污水的pH,试纸显深蓝色。
(1)由此可知,该污水中肯定含有的离子是 ,肯定没有的离子是 ,
可能含有的离子是 。
(2)如何通过实验进一步确定溶液中可能存在的离子?
解析:本题利用社会热点问题结合离子共存和离子检验判断考查离子反应问题,注意Fe3+在水溶液中呈黄色,检验时注意离子的干扰。
答案:(1)Ba2+、OH- Fe3+、CO、SO K+、Cl- (2)用铂丝蘸少量试液在酒精灯火焰上灼烧,透过蓝色钴玻璃,若发现火焰呈紫色,则说明含有K+。另取少量试液于一洁净试管中,加几滴AgNO3溶液,若有白色沉淀生成,再加入HNO3后沉淀不溶解,则说明溶液中含有Cl-。
14. 下列每组中的两种物质相互反应时,无论谁过量都可用同一个离子方程式表示的是( )
A. 四羟基合铝酸钠溶液和盐酸 B.磷酸二氢钠溶液和澄清石灰水
C.苯酚钠溶液和二氧化碳 D.硝酸银溶液和氨水
解析:A项盐酸过量和偏铝酸钠过量时的离子方程式分别为:[Al(OH)4]-+4H+===Al3++4H2O,[Al(OH)4]-+H+===Al(OH)3↓+H2O;B项中磷酸二氢钠过量和石灰水过量的离子方程式分别为2H2PO+Ca2++2OH-===CaHPO4↓+HPO+2H2O,2H2PO+3Ca2++4OH-===Ca3(PO4)2↓+4H2O;C项无论谁过量,离子方程式均为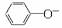 +H2O+CO2―→
+H2O+CO2―→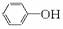 +HCO;D项硝酸银溶液过量和氨水过量的离子方程式分别为:
+HCO;D项硝酸银溶液过量和氨水过量的离子方程式分别为:
2Ag++2NH3·H2O===Ag2O↓+2NH+H2O,Ag++2NH3·H2O===[Ag(NH3)2]++2H2O。
答案:C
13.HgCl2的稀溶液可用作手术的消毒剂,已知HgCl2的熔点为276℃。熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力,则下列关于HgCl2的叙述中正确的是( )
A. HgCl2属于共价化合物 B.HgCl2属于离子化合物
C.HgCl2属于非电解质 D.HgCl2属于强电解质
解析:HgCl2的熔点低且熔融状态不导电,故为共价化合物,弱的导电性说明属于弱电解质。
答案:A
12.下列离子方程式不正确的是( )
A. 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+H2↑+Cl2↑
B.用银氨溶液检验乙醛中的醛基:
CH3CHO+2[Ag(NH3)2]++2OH-CH3COO-+NH+3NH3+2Ag↓+H2O
C.苯酚钠溶液中通入少量CO2:CO2+H2O+C6H5O-―→C6H5OH+HCO
D.Na2SO3溶液使酸性KMnO4溶液退色:
5SO+6H++2MnO===5SO+2Mn2++3H2O
解析:A项中的反应物是H2O而不能写为H+;注意C项中产物是生成HCO而不能生成CO;B和D都正确。
答案:A
11.在一种能使pH试纸变红色的溶液中,下列离子因发生氧化还原反应而不能大量共存的是( )
①Ag+、Na+、Al3+、Cl- ②Fe2+、NO、Cl-、Na+ ③K+、Mg2+、CH3COO-、SO ④K+、H+、SO、I- ⑤Na+、NO、SO、I-
A.②⑤ B.①②④ C.②③⑤ D.全部
解析:能使pH试纸变红色的溶液是酸性溶液。①中Ag+和Cl-因反应生成沉淀AgCl而不共存,②中发生氧化还原反应3Fe2++NO+4H+===3Fe3++NO↑+2H2O而不共存,③中CH3COO-与H+不能共存,④中H+、SO反应生成SO2而不共存,但③④是非氧化还原反应,⑤中发生氧化还原反应2NO+6I-+8H+===3I2+2NO↑+4H2O而不共存。
答案:A
10.(2008·广东,11)下列化学反应的离子方程式正确的是( )
A. 在稀氨水中通入过量CO2:NH3·H2O+CO2===NH+HCO
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-===CaSO3↓+2HClO
C.用稀HNO3溶解FeS固体:FeS+2H+===Fe2++H2S↑
D.氢氧化钙溶液与等物质的量的稀硫酸混合:
Ca2++OH-+H++SO===CaSO4↓+H2O
解析:Ca(ClO)2具有强氧化性,而SO2具有强还原性,二者会发生氧化还原反应,不可能生成CaSO3,而生成CaSO4;稀HNO3具有强氧化性,而FeS具有还原性,二者发生氧化还原反应生成Fe3+和S;等物质的量的Ca(OH)2溶液与稀H2SO4混合的离子方程式为Ca2++2OH-+2H++SO===CaSO4↓+2H2O。
答案:A
9. (2008·四川理综,11)能正确表示下列反应的离子方程式是( )
A. 足量硫酸铝与纯碱反应:2Al3++3CO+3H2O===2Al(OH)3↓+3CO2↑
B.硫酸铜与烧碱反应:CuSO4+2OH-===Cu(OH)2↓+SO
C.苯酚与碳酸钠反应:2C6H5OH+CO===2C6H5O-+CO2↑+H2O
D.碳酸钡与硫酸反应:Ba2++SO===BaSO4↓
解析:B中的CuSO4应写成离子形式,SO不参与反应;C中C6H5OH的酸性比碳酸弱,因此C6H5OH与Na2CO3反应不能放出CO2,只能生成NaHCO3;D中BaCO3为难溶盐,应写成分子式;因此只有A正确。
答案:A
8.(2008·重庆理综,9)下列各组离子在给定条件下能大量共存的是( )
A. 在pH=1的溶液中:NH、K+、ClO-、Cl-
B.有SO存在的溶液中:Na+、Mg2+、Ca2+、I-
C.有NO存在的强酸性溶液中:NH、Ba2+、Fe2+、Br-
D.在c(H+)=1.0×10-13 mol/L的溶液中:Na+、S2-、[Al(OH)4]-、SO
解析:A项中ClO-与H+不大量共存;B项中SO与Ca2+不大量共存;C项中NO、H+、Fe2+相互结合会发生氧化还原反应而不能大量共存;D项中无离子反应,可以共存。
答案:D
7.能大量共存于同一溶液中,且当溶液中加入过量的NaOH溶液或少量稀硫酸时,都能产生白色沉淀的离子组是( )
A. Ba2+、Mg2+、NO、CO B.H+、Ba2+、Al3+、Cl-
C.K+、Ba2+、Cl-、HCO D.NH、Ba2+、Fe3+、Cl-
解析:Ba2+、Mg2+与CO不共存,A错;B选项中加过量的NaOH无白色沉淀生成;C正确;D加过量的NaOH产生Fe(OH)3红褐色沉淀不符合题意。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com