
题目列表(包括答案和解析)
4、解答此类试题还要抓住题干提示信息,如a.是否有颜色(中学常见有色离子只有Fe3+、Fe2+、Cu2+、MnO4-四种离子。)b.要求共存还是不共存。c.溶液酸碱性提示信息:有的直接给出是在强酸性或强碱性溶液中;有的给出溶液的pH;有的以某种指示剂显色形式给出;还有的以该水溶液中水电离出的H+或OH-离子的浓度形式给出,此时往往有两个选项或是两个子选项的组合,等等。
3、Fe3+因其在水溶液中当pH为3.7左右即可沉淀为Fe(OH)3 ,所以Fe3+与几乎所有的弱酸根离子都不能大量共存,如ClO-、[Al(OH)4]-、CO32-等。
2、能生成微溶物质的两种离子也不能大量共存,如Ca2+与SO42-,Ag+与SO42-,Ca2+与 OH- 等。
1、弱酸的酸式根离子既不能与OH-大量共存也不能与H+大量共存。如
HCO3-+OH- H2O+CO32- ;HCO3-+ H+
H2O+CO32- ;HCO3-+ H+ CO2↑+H2O。
CO2↑+H2O。
4、能否发生络合反应,如Fe3++3SCN- Fe(SCN)3 。
Fe(SCN)3 。
以上四条又可概括为一条:只要能使溶液中某些离子的数量减少,该溶液中的离子就不能大量共存。
3、能否发生双水解反应。如:2Al3++3S2-+6H2O 2Al(OH)3↓+3H2S↑;
2Al(OH)3↓+3H2S↑;
Al3++3HCO3- Al(OH)3↓+3 CO2↑。
Al(OH)3↓+3 CO2↑。
2、能否发生氧化还原反应。常见的离子间氧化还原反应有下列几组:
2Fe3++S2-  2Fe2++S ↓; 2Fe3++2I-
2Fe2++S ↓; 2Fe3++2I- 2Fe2++I2
2Fe2++I2
3Fe2++NO3-+4H+ 3Fe3++NO↑++2H2O
3Fe3++NO↑++2H2O
S2O32-+2H+ S↓+SO2↑+H2O
S↓+SO2↑+H2O
特别要指出的是ClO-在碱性条件下与还原性离子:I-、S2-、 SO32-、Fe2+等因发生氧化还原反应也不能共存。
要解答离子在溶液中能否大量共存,首先要看能否发生下列四个方面的反应:
1、能否发生复分解反应。复分解反应能否发生的条件又要看是否有难溶、难电离、易挥发性物质生成。
14.在标准状况下,取甲、乙、丙各30.0mL相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉末,得下表中有关数据(假设反应前后溶液体积不发生变化)。请回答:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量/mg |
255 |
385 |
459 |
|
气体体积/mL |
280 |
336 |
336 |
(1)甲组实验中,盐酸(选填“过量”、“适量”或“不足量”,下同)__________;乙组实验中盐酸__________。
(2)盐酸的物质的量浓度为__________。
(3)合金中Mg、Al的物质的量之比为__________。
(4)丙实验之后,向容器中加入一定量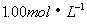 NaOH溶液,能使合金中的铝粉恰好完全溶解,再过滤出不溶性固体,求所得滤液中各物质的物质的量浓度。
NaOH溶液,能使合金中的铝粉恰好完全溶解,再过滤出不溶性固体,求所得滤液中各物质的物质的量浓度。
标况下往500mL FeBr2溶液中缓缓通入4.48L Cl2,测得溶液中有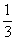 的Br-被氧化成Br2单质,求原FeBr2的物质的量浓度。
的Br-被氧化成Br2单质,求原FeBr2的物质的量浓度。
13.在一定条件下,RO3n-和I-发生反应的离子方程式如下:
RO3n-+6I-+6H+=R-+3I2+3H2O.
(1)RO3n-中R元素的化合价是_______。(2)R元素的原子最外层的电子数是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com