
题目列表(包括答案和解析)
12. 实验室制取下列气体时,下列尾气吸收方法中不正确的是( )
A.Cl2的尾气,可用NaOH溶液吸收 B.H2S的尾气,可用CuSO4溶液吸收
C.SO2的尾气,可用KMnO4溶液吸收 D.NO2的尾气,可用H2O来吸收
解析:A、B、C三项中气体均可与吸收液反应而被吸收,但D项中NO2与水反应后生成的NO可与空气中的O2反应生成NO2,依然会造成污染。
答案:D
11.下列实验的操作处理,能有效改变反应速率且达到要求的是( )
A.为增大泡沫灭火器中的Al2(SO4)3与小苏打的反应速率,改用小苏打和苏打的混合物
B.为加快盐酸和锌制取氢气的速率又不减少氢气的量,可加少量硝酸银溶液
C.在稀硫酸和铁粉反应制取氢气时,为减慢反应速率,可以加入适量醋酸钠
D.用3 mL乙醇、2 mL浓H2SO4、2 mL冰醋酸制乙酸乙酯,为增大反应速率,可改用6 mL
乙醇、4 mL浓H2SO4、4 mL冰醋酸
解析:A项改用小苏打与苏打的混合物后,反应速率减慢;B项加入AgNO3溶液后,由于在酸性条件下NO的强氧化性,不能制得H2,而得到NO;D项,改变纯液态物质的用量不改变反应速率,而C项中CH3COO-与H+结合生成弱酸,降低了H+的浓度,减缓了反应速率。
答案:C
10.可用如下图所示装置干燥、收集及尾气处理的气体是( )

①H2S ②HCl ③NH3 ④Cl2 ⑤SO2 ⑥C2H4
A.①和② B.②和⑤
C.③和④ D.⑤和⑥
解析:①③中气体不能用浓H2SO4干燥,④不能用水吸收Cl2,⑥不能用向上排空气法收集,HCl、SO2必须用防倒吸装置进行尾气处理。
答案:B
9.下图装置可用于( )
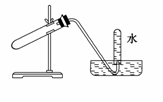
A.加热NaHCO3制CO2
B.用Cu与稀HNO3反应制NO
C.用NH4Cl与浓NaOH溶液反应制NH3
D.用NaCl固体与浓H2SO4反应制HCl
解析:A项,缺少加热装置,且CO2不宜用排水法收集,故A项不正确;由收集装置知气体不溶于水,C、D项不正确。
答案:B
8. 现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
解析:①两种液体互不相溶,采用分液法分离,②中两种液体相溶,但沸点不同,用蒸馏法分离,③中溴在有机溶液中的溶解度大于水中的溶解度,故采用萃取法分离。
答案:C
7.在实验室进行下列有关物质的制备流程中,理论上正确、操作上可行且经济上合理的是( )
A.CCOCuO△CO2Na2CO3
B.CuCu(NO3)2溶液Cu(OH)2
C.CaOCa(OH)2溶液NaOH溶液
D.FeFe2O3Fe2(SO4)3溶液
解析:解题的关键是:准确判断在实验室进行的物质的制备过程中,要理论上正确、操作上可行且经济上合理。A项中实验室里用在空气中点燃单质碳来制备CO的方法,在操作上是不可行的;B项中用硝酸银溶液与铜反应来制备Cu(NO3)2是不经济的;D项中用铁点燃燃烧制备氧化铁在理论上不正确、操作上不可行;只有C符合要求。
答案:C
6. 下列除杂质的方法不可行的是( )
A.用过量氨水除去Al3+溶液中的少量Fe3+
B.将混合气体通过灼热的铜网除去N2中的少量O2
C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D.用盐酸除去AgCl中少量的Ag2CO3
解析:在Al3+、Fe3+的混合溶液中加入过量氨水,生成Al(OH)3、Fe(OH)3沉淀,不能将Al3+、Fe3+分离;N2、O2的混合气体通过灼热的铜网,发生反应2Cu+O22CuO,O2被除去;乙醇中含有的少量水不能直接用蒸馏的方法除去,应先加入CaO再蒸馏;在AgCl、Ag2CO3混合物中加入HCl,发生反应Ag2CO3+2HCl===2AgCl+H2O+CO2↑,经过滤可得纯净的AgCl。
答案:A
5.某混合气体G可能含有CO、CO2、SO2、H2O等气体,用a.无水CuSO4,b.澄清石灰水,c.灼热CuO,d.碱石灰,e.酸性品红溶液,f.酸性高锰酸钾溶液等药品可将其一一检出,检出的正确顺序是( )
A . a→a→e→b→f→d→c B. c→c→d→b→e→f→a
C . a→a→e→f→b→d→c D. b→b→e→f→a→d→c
解析:首先用无水CuSO4检验水,然后用酸性品红溶液检验SO2,因为SO2和CO2均使澄清石灰水变浑浊,因此应用酸性KMnO4除去SO2后再用澄清石灰水检验CO2,最后用碱石灰干燥剩余气体后,再用灼热CuO检验CO的存在。
答案:C
4.(2008·北京理综,9)下列各组物质的无色溶液,不用其它试剂即可鉴别的是( )
①KOH Na2SO4 AlCl3 ②NaHCO3 Ba(OH)2 H2SO4
③HCl Na[Al(OH)4] NaHSO4
④Ca(OH)2 Na2CO3 BaCl2
A.①② B.②③ C.①③④ D.①②④
解析:①相互滴加时,Na2SO4滴入另外两种溶液中无明显现象,KOH和AlCl3相互滴加现象不同:KOH逐滴加入AlCl3中立刻产生沉淀,而AlCl3滴入KOH中开始无明显现象,后迅速产生大量沉淀,从而可以区别开来;②相互滴加能产生两种白色沉淀的是Ba(OH)2,向两种白色沉淀中分别滴加NaHCO3或H2SO4,能够将一种白色沉淀溶解的是H2SO4;
③和④相互滴加时无法区别。
答案:A
3.根据下列实验事实得出的结论正确的是( )
A.气体品红溶液退色 结论:原气体一定是SO2
B.气体气体白色沉淀 结论:原气体一定是烃
C.某溶液冒白雾用沾有浓氨水的玻璃棒靠近白烟 结论:原溶液一定是浓盐酸
D.某有色溶液紫色 结论:原溶液中一定含有Fe3+
解析:A项中O3、Cl2、NO2等都能使品红溶液退色;B项中H2S、CxHy、HCHO都可出现此现象;C项中浓HNO3等也有此现象。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com