
题目列表(包括答案和解析)
7.(2009·潍坊统考)铍(Be)与铝的性质相似,已知反应BeCl2+Na2BeO2+2H2O===2NaCl+2Be(OH)2↓能进行完全。据此作出的以下推断中正确的是( )
A.常温时,BeCl2溶液pH>7,将其蒸干、灼烧后可得残留物BeCl2
B.常温时,Na2BeO2溶液pH<7,将其蒸干、灼烧后可得残留物Na2BeO2
C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
D.BeCl2水溶液的导电性较强,说明BeCl2一定是离子化合物
解析:根据题目信息知,A项中BeCl2溶液pH<7,加热蒸干灼烧得氧化铍,B项Na2BeO2应是pH>7,D项导电性强不一定是离子化合物。
答案:C
6. 已知K2HPO4溶液中HPO的水解程度大于电离程度,对于平衡:HPO+H2O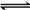

H3O++PO,欲使K2HPO4溶液中c(HPO)、c(H3O+)、c(PO)三种离子浓度均减小,可采取的方法是( )
A.加水 B.加少量消石灰固体 C.加热 D.加少量硝酸银固体
解析:加水、加热均促进电离,可能会使c(PO)变大,加硝酸银固体促进上述平衡右移,使c(H3O+)变大。
答案:B
5.一种常用的泡沫灭火器构造如图。内筒a是玻璃瓶,外筒b是钢瓶,平时泡沫灭火器内筒外筒盛有液态试剂,当遇火警时,将灭火器取下倒置,内外筒液体试剂立即混合产生大量CO2泡沫灭火,从液态试剂在灭火器中长久放置和快速灭火两个角度分析,盛放药品正确的是( )
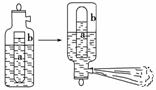
A.a中盛饱和Na2CO3溶液,b中盛Al2(SO4)3溶液
B.a中盛饱和NaHCO3溶液,b中盛Al2(SO4)3溶液
C.a中盛Al2(SO4)3溶液,b中盛饱和Na2CO3溶液
D.a中盛Al2(SO4)3溶液,b中盛饱和NaHCO3溶液
解析:本题以生活中常见泡沫灭火器为素材综合考查盐类水解以及影响水解的因素等考点,着重培养学生运用化学基本理论解决实际问题的能力。Al2(SO4)3是强酸弱碱盐水溶液呈酸性,若久置于钢瓶中则腐蚀钢瓶。从久置角度考虑内筒应盛Al2(SO4)3溶液,外筒应盛饱和NaHCO3溶液;因CO+H+===HCO HCO+H+===H2O+CO2↑,所以从快速产生CO2灭火的角度看应选饱和NaHCO3,而不应选饱和Na2CO3溶液。
答案:D
4.下列各离子①R- ②R+ ③R2+ ④R3+ ⑤RH ⑥RH-(R表示不同的元素)都有10个电子,其中不会破坏水的电离平衡的有( )
A.仅有②③ B.仅有② C.②③⑥ D.②③⑤
解析:它们分别为F-、Na+、Mg2+、Al3+、NH、OH-,其中只有Na+不会破坏水的电离平衡。
答案:B
3.(2009·潍坊统考)有四种物质的量浓度相等、且都由一价阳离子A+和B+及一价阴离子X-和Y-组成的盐溶液。据测定常温下AX和BY溶液的pH=7,AY溶液的pH>7,BX溶液的pH<7。由此判断可能不水解的盐是( )
A.BX B.AX C.AY D.BY
解析:由AY溶液pH>7知A+是强碱阳离子,Y-是弱酸阴离子,BX溶液pH<7知X-应是强酸阴离子,而B+为弱碱阳离子,故不水解的盐应是AX。
答案:B
2. 下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 ②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用 ④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 ⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A.①②③ B.②③④ C.①④⑤ D.①②③④⑤
解析:本题考查盐类水解的应用与解释。①中NH4Cl与ZnCl2溶液水解均显酸性,可以除去金属表面的锈;②用HCO与Al3+两种离子水解相互促进,产生二氧化碳,可作灭火剂;③草木灰主要成分为碳酸钾,水解显碱性,而铵态氮肥水解显酸性,因而不能混合施用;④碳酸钠溶液水解显碱性,而磨口玻璃塞中的二氧化硅会与碱反应生成硅酸钠将瓶塞与瓶口黏合而打不开,因此实验室盛放碳酸钠的试剂瓶应用橡胶塞;⑤AlCl3溶液中存在水解平衡:AlCl3+3H2O 
 Al(OH)3+3HCl,加热时,HCl挥发使平衡不断右移,最终得到Al(OH)3固体(如果灼烧,会得到Al2O3固体)。
Al(OH)3+3HCl,加热时,HCl挥发使平衡不断右移,最终得到Al(OH)3固体(如果灼烧,会得到Al2O3固体)。
答案:D
1.在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
解析:pH=11的NaOH溶液中c(NaOH)=c(OH-)=10-3 mol/L,而pH=3的CH3COOH溶液中c(H+)=10-3 mol/L,c(CH3COOH)远远大于10-3 mol/L。两者等体积混合后,形成CH3COOH与CH3COONa混合液,且c(CH3COOH)远大于c(CH3COONa),溶液呈酸性,电荷守恒关系为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),离子浓度大小顺序为
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
答案:D
10.(1)25℃时,0.1 mol/L NaOH溶液的pH为________;
(2)25℃时,0.1 mol/L NH4Cl溶液的pH______7(填“<”、“=”或“>”),其原因是
________________________________________________________________________
(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
A.c(Na+)>c(Cl-)>c(OH-)>c(H+) B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Na+)=c(Cl-)>c(OH-)>c(H+) D.c(Cl-)>c(Na+)>c(OH-)>c(H+)
解析:0.1 mol/L NaOH溶液的c(OH-)=0.1 mol/L,c(H+)=mol/L=10-13 mol/L,Ph
=-lg[c(H+)]=13;由于NH能结合水电离出来的OH-生成弱电解质NH3·H2O,破坏了水
的电离平衡,使溶液显酸性;将两种溶液等体积混合,发生反应:NaOH+NH4Cl===NaCl
+NH3·H2O,Na+和Cl-均不水解,故浓度相等,NH3·H2O能电离出OH-,使c(OH-)>
c(H+)。
答案:(1)13 (2)< NH+H2ONH3·H2O+H+ (3)C
9.(2009·潍坊11月统考)碳、氮元素及其化合物与人类的生产生活密切相关。试回答下列有关
问题:
(1)NH3极易溶于水,其水溶液俗称氨水。用水稀释0.1 mol·L-1的氨水,溶液中随着水量的
增加而减小的是________(填序号)。
a. b.
c.c(H+)·c(OH-) d.
(2)标准状况下,将1.12 L CO2通入100 mL 1 mol·L-1的NaOH溶液中,所得溶液中离子浓
度由大到小的顺序为________________________________________________________________________;
用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+________________________________________________________________________;
②c(H+)+c(Na+)=________________________________________________________________________。
(3)甲烷燃料电池中发生的化学反应为:CH4+2O2===CO2+2H2O,该电池的电解质溶液为
H2SO4溶液,则原电池工作时电解质溶液中向正极移动的离子是________。
 解析:(1)在氨水中存在NH3·H2O NH+OH-的平衡,加水稀释时平衡右移,但NH和OH-的浓度均减小,可借助Kb=,KW=c(H+)·c(OH-)判断出b、d正
解析:(1)在氨水中存在NH3·H2O NH+OH-的平衡,加水稀释时平衡右移,但NH和OH-的浓度均减小,可借助Kb=,KW=c(H+)·c(OH-)判断出b、d正
确。
(2)将CO2通入NaOH溶液中可生成正盐,也可生成酸式盐,甚至两种都有,则依据反应物
的物质的量知发生反应为:CO2+2NaOH===Na2CO3+H2O,离子浓度关系为:c(Na+)>
c(CO)>c(OH-)>c(HCO)>c(H+)
①c(OH-)=2c(H2CO3)+c(HCO)+c(H+)
②c(H+)+c(Na+)=c(OH-)+c(HCO)+2c(CO)
(3)向正极移动的离子是阳离子,故是H+。
答案:(1)bd (2)c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H+) ①c(OH-)=2c(H2CO3)+
c(HCO)+c(H+) ②c(H+)+c(Na+)=c(OH-)+c(HCO)+2c(CO) (3)H+
8.在纯碱溶液中滴入酚酞,所观察到的现象是
_______________________________________________________________________,
若在该溶液中逐滴加入过量的氯化钙溶液,所观察到的现象是________________________________________________________________________,
其原因是(以离子方程式和简要文字说明):________________________________________________________________________
________________________________________________________________________。
解析:由于CO水解使溶液显碱性,滴入酚酞,溶液变红;当向溶液中逐滴加入过量的氯
化钙溶液,Ca2+结合CO生成了白色的CaCO3沉淀,使CO水解平衡向左移动,溶液的
碱性变弱,溶液的红色变浅,直至退去。
答案:溶液变红 溶液中生成了白色的沉淀,溶液红色变浅直到退去 纯碱溶液中滴入酚
酞,由于CO水解溶液显碱性,使溶液呈红色,CO+H2OHCO+OH-;当向溶液
中滴入过量的氯化钙溶液,Ca2+结合CO生成了白色的CaCO3沉淀,Ca2++CO
===CaCO3↓,使CO水解平衡向左移动,溶液的碱性变弱,溶液的红色变浅,直至退去
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com