
题目列表(包括答案和解析)
3. (2008·北京理综,26)通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+=== I2+Z+H2O常作为Y的鉴定反应。
(1)Y与Z的关系是__________(选填字母)。
a.同位素 b.同系物 c.同素异形体 d.同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红退色。简述用退色的溶液区别二者的实验方法________________________________________________________________________。
(3)举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)。
________________________________________________________________________。
(4)气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种弱酸)。
①HCN分子中含有4个共价键,其结构式是_____________________________________。
②KCN溶液显碱性,原因是(用离子方程式表示)___________________________________
________________________________________________________________________。
(5)加热条件下,足量的Z与某金属M的盐MCR3(C为碳元素)完全反应生成CR2和MmRn(m、n均为正整数)。若CR2质量为w1g,MmRn质量为w2g,M的相对原子质量为a,则MmRn中m∶n=__________(用含w1、w2和a的代数式表示)。
解析:(1)由X的组成元素是第三周期原子半径最小的元素知X为Cl2;Y和Z是均由元素R组成的气态单质,极易想到的是O2和O3,再由题干方程式的氧化还原关系可知Y是O3,Z是O2,则Y与Z为同素异形体。
(2)由SO2的漂白是可恢复性(化合的性质)漂白及O3的不可恢复性(强氧化性)漂白可以选择如答案的方法。
(3)可依据铁的变价去体现:2Fe+3Cl22FeCl3,S+FeFeS或Cl2+H2S===2HCl+S↓体现。
(4)①利用C四价健、N三价健关系可知为H-C≡N。
②CN-水解:CN-+H2O HCN+OH-。
HCN+OH-。
(5)根据质量守恒可以写出反应的方程式并列数据:
O2+mMCO3===mCO2+MmOn
44m ma+16n
w1 g w2 g
列比例式=解得m∶n=16w1∶(44w2-aw1)。
答案:(1)c (2)加热退色后的溶液,若溶液恢复红色,则原通入气体为SO2;若溶液不变红,则原通入气体是O3 (3)2Fe+3Cl22FeCl3,Fe+SFeS(其他合理答案均可) (4)①H-C≡N ②CN-+H2O HCN+OH- (5)16w1∶(44w2-aw1)
HCN+OH- (5)16w1∶(44w2-aw1)
2.下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:
A.A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。
B.反应①②是化工生产中的重要反应。
C.化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。
D.化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。
E.化合物J由两种元素组成,其相对分子质量为32。
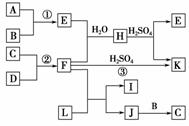
请按要求填空:
(1)反应③的化学方程式_______________________________________________________。
(2)C的结构式________;H的化学式________。
(3)L的溶液与化合物E反应的离子方程式________________。
(4)化合物J的化学式________。
解析:综合分析已知条件A、B、C,由E是形成酸雨的污染物(猜测为SO2),K是氮肥[猜测为(NH4)2SO4]。B、C、D是气体以及①是硫酸工业中由硫黄制硫酸的第一步反应(造气)、②是合成氮的反应可搞清楚上面两条转化链:S+O2―→SO2(NH4)2SO3或NH4HSO3SO2+(NH4)2SO4,N2+H2―→NH3(NH4)2SO4。再对下面这条转化链进行分析:L具有漂白性,可由Cl2与NaOH溶液反应制得,则L是NaClO,F是NH3,NH3与NaClO间必发生氧化还原反应,N元素的化合价升高,而生成的J又能与O2反应生成N2,说明J中氮元素的化合价还是负价,结合“J由2种元素组成,相对分子质量为32”,这一条件,可判断J是N、H组成的化合物(不可能是N元素与O、Na或Cl元素形成的化合物),其化学式为N2H4(名称为联氨或肼,结构为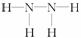 )。
)。
答案:(1)2NH3+H2SO4===(NH4)2SO4 (2)N≡N (NH4)2SO3或NH4HSO3
(3)ClO-+SO2+2OH-===Cl-+SO+H2O (4)N2H4
1.A、B、C是中学化学中常见的三种元素的单质。A、B、C及其他物质的关系如下图所示,其中B、D、E、F的水溶液呈酸性,又知常温下B为气态。

请回答:
(1)A、B、C三种单质分别是:A__________、B__________、C__________。
(2)B与C反应生成E时的反应现象是________________________________________________________________________。
(3)写出下列变化的离子方程式:
F+B―→D____________________;D+C―→E+F__________________。
(4)E溶液显酸性的离子方程式:________________________________________________________________________。
解析:单质B常温下呈气态且水溶液呈酸性,可确定B是Cl2。而单质A+Cl2―→D,化合物F+B―→D,即F+Cl2―→D,说明A元素的化合物具有可变价态,且是金属,可判断A是Fe。再研究各物质之间的转化关系:D+C―→E+F,即FeCl3+C―→E+FeCl2,说明C具有还原性,又是单质,则为金属,同时E+A―→F+C,即E+Fe―→FeCl2+C,这是一个置换反应,C的金属活动性小于Fe,从而确定C为Cu。
答案:(1)Fe Cl2 Cu (2)产生棕黄色的烟 (3)2Fe2++Cl2===2Fe3++2Cl- Cu+2Fe3+===Cu2++2Fe2+ (4)Cu2++2H2OCu(OH)2+2H+
9.A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为________;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为_______,C的元素符号为________;
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的电子排布式为________;
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为________。
解析:(1)A元素基态原子的轨道排布图由题意可写成:
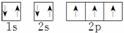 ,可见该元素核外有7个电子,为氮元素,其元素符号为N。
,可见该元素核外有7个电子,为氮元素,其元素符号为N。
(2)B-、C+的电子层结构都与Ar相同,即核外都有18个电子,则B为17号元素Cl,C为19号元素K。
(3)D元素原子失去2个4s电子和1个3d电子后变成+3价离子,其原子的核外电子排布式为1s22s22p63s23p63d64s2即26号元素铁。
(4)根据题意要求,首先写出电子排布式:1s22s22p63s23p63d104s1,该元素为29号Cu。
答案:(1)N (2)Cl K (3)Fe 1s22s22p63s23p63d64s2或[Ar]3d64s2
(4)Cu 1s22s22p63s23p63d104s1或[Ar]3d104s1
8. 下表为周期表的一部分,其中的编号代表对应的元素。
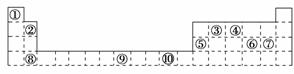
请回答下列问题:
(1)表中属于d区的元素是________(填编号)。
(2)写出元素⑨的基态原子的电子排布式________________________________________________________________________。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为______对。
(4)元素④的氢化物的分子构型为________________,中心原子的杂化形式为________。
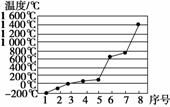
(5)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表________(填元素符号);其中电负性最大的是________(填图中的序号)。
解析:(2)⑨号元素是Fe元素,其电子排布式为1s22s22p63s23p63d64s2。
(3)由nsnnpn+1可知n=2,则该元素是N,其最外层成对电子只有1对。
(4)元素④是氮元素,其氢化物的分子构型是三角锥型。
(5)第三周期熔点最高的单质应是Si;电负性最大的是Cl即图中的2。
答案:(1)⑨ (2)1s22s22p63s23p63d64s2 (3)1 (4)三角锥型 sp3 (5)Si 2
7.a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
|
微粒代码 |
a |
b |
c |
d |
e |
f |
g |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
带电荷数(单位电荷) |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:
(1)a微粒的电子式________________;
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为________>________(用化学式表示);
(3)d的结构简式________________;
(4)g微粒所属化合物类型________,是________分子(填“极性”或“非极性”);
(5)用化学式表示:c微粒是________;f微粒是________。
解析:10电子的微粒有:原子Ne;分子CH4、NH3、H2O、HF(均为第二周期非金属元素的气态氢化物);简单阳离子Na+、Mg2+、Al3+(均为第三周期金属元素形成的阳离子);复杂阳离子H3O+、NH;简单阴离子N3-、O2-(以上两种离子不能在水溶液中稳定存在)、F-;复杂阴离子OH-。
可知:a为Ne;b为Na+;c为OH-;d为NH3;e为Mg2+;f为H3O+(H3O++OH-===2H2O);g为H2O。
答案:(1)···· (2)NaOH Mg(OH)2 (3)
 (4)共价化合物 极性
(4)共价化合物 极性
(5)OH- H3O+
6.如图为元素周期表的一部分。X、Y、Z、W均为短周期元素,若W原子的最外层电子数是其次外层电子数的7/8。则下列说法中正确的是( )
|
X |
Y |
|
|
|
Z |
W |
A.Y单质可与Z的氢化物的水溶液反应,使溶液pH升高
B.最高价氧化物的水化物酸性:W>Z
C.原子半径由大到小的排列顺序是Z>Y>X
D.X的单质中有一种为白色蜡状固体
解析:由W的原子结构特点可推知W为氯元素,则依它们在元素周期表中的位置关系可知X、Y、Z依次为氮元素、氧元素和硫元素。A中的反应是2H2S+O2===2S↓+2H2O,A正确;HClO4酸性强于H2SO4,B正确;X、Y、Z的原子半径应是Z>X>Y,C不对;N元素的单质为无色气体,D不对。
答案:AB
5. 已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是( )
|
元素 |
I1 |
I2 |
I3 |
I4 |
|
X |
500 |
4 600 |
6 900 |
9 500 |
|
Y |
580 |
1 800 |
2 700 |
11 600 |
A . 元素X的常见化合价是+1
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
解析:X的第一电离能(I1)显著小于I2、I3等,可知X最外层只有一个电子,故常见化合价为+1价,且与Cl元素形成XCl,A、C两项正确;Y元素的I1、I2、I3相差不悬殊,与I4悬殊明显,故Y最外层有3个电子,为ⅢA族元素,当n=3时,Y为Al,与冷水不反应,故B正确,而D错误。
答案:D
4.具有下列电子层结构的原子和离子,其对应的元素一定属于同一周期的是( )
A.两原子其核外全部都是s电子
B.最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子
C.原子核外M层上的s、p能级都充满电子,而d能级上没有电子的两种原子
D.两原子N层上都有1个s电子,一个原子有d电子,另一个原子无d电子
解析:氢原子和锂原子都只有s电子但不在同一周期,A错;2s22p6的离子如果是阳离子的话,对应的元素就和2s22p6的原子对应的元素不在同一周期,B错;虽然M层上的s、p能级都充满电子,即使d能级没有电子,但4s上可能有电子或没有电子,C错。
答案:D
3.下列各组原子中,彼此化学性质一定相似的是( )
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上只有一个电子的X原子与3p轨道上只有一个电子的Y原子
D.最外层都只有一个电子的X、Y原子
解析:A中1s2结构的原子为He,1s22s2结构的原子为Be,两者性质不相似;B项X原子为Mg,Y原子N层上有2个电子的有多种元素,如第四周期中Ca、Fe等都符合,化学性质不一定相似;C项为同主族的元素,化学性质一定相似;D项最外层只有1个电子的碱金属元素可以,过渡元素中也有很多最外层只有1个电子的,故性质不一定相似。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com