
题目列表(包括答案和解析)
14.下列化学用语表示错误的是( )
A.羟基的电子式: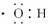 B.中子数为14的硅原子:Si
B.中子数为14的硅原子:Si
C.镁离子的结构示意图: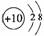 D.甲烷的分子模型:
D.甲烷的分子模型:
解析:本题考查了几种常见的化学用语,解答时注意从其概念的内涵与外延出发,缜密思考,正确解答。
羟基为中性自由基,内含单电子,A正确;硅的原子序数为14,其质量数为14+14=28,B正确;镁离子的核电荷数为12,外层10个电子,C错误;甲烷分子为5原子的空间正四面体分子,D正确。
答案:C
13.2007年10月24日,我国成功发射了“嫦娥一号”月球探测火箭,其主要任务之一是评估月球上土壤的厚度和3He的资源量,以下关于3He的说法正确的是( )
A.是4He的同素异形体
B.比4He多一个中子
C.是4He的同位素
D.3He代表原子核内有2个质子和3个中子的氦原子
解析:该题以人类关注程度较大的社会热点材料为背景,以3He为载体考查原子结构中有关“量”的关系及同位素、同素异形体的概念,侧重考查学生的辨别能力。很好地体现了源自生活、落于教材的课标精神。
同素异形体是指单质,而同位素是指原子,故A错;4He为2质子2中子的原子而3He为2质子1中子的原子,故B、D错。
答案:C
12. 下列指定粒子的个数比为2∶1的是( )
A.Be2+中的质子和电子
B. H原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
解析:Be2+中质子数为4,电子数为2,符合要求; H原子中中子数为1,质子数为1,不符合要求;NaHCO3晶体中阳离子Na+和阴离子HCO的个数比等于1∶1,不符合要求;BaO2固体中阴离子O和阳离子Ba2+的个数比等于1∶1,不符合要求。
答案:A
11.(2008·全国理综Ⅱ,11)某元素的一种同位素X的质量数为A,含N个中子,它与H原子组成HmX分子。在a g HmX中所含质子的物质的量是( )
A.(A-N+m) mol B.(A-N) mol
C.(A-N) mol D.(A-N+m) mol
解析:同位素X的质量数为A,中子数为N,因此其质子数为A-N。故HmX分子中的质子数为m+A-N,又由于HmX中H为H,故a g HmX分子中所含质子的物质的量为:
×(A+m-N)mol。
答案:A
10.已知X、Y均为1-18号之间的元素,X、Y可形成化合物X2Y和X2Y2,又知Y的原子序数小于X的原子序数,则这两种元素的原子序数之和为( )
A.19 B.18 C.16 D.9
解析:解法一(联想):根据以往知识,符合X2Y、X2Y2形式的分子式有Na2O、Na2O2和H2O、H2O2两组,但第二组不符合Y的原子序数小于X的原子序数的条件,而第一组不仅符合,而且选项中有。
解法二(推理):由X2Y化学式看。
(1)X的化合价如为+1价,则Y为-2价。
(2)X的化合价如为+2价,则Y为-4价(不成立)。故只有第一种情况可行。由化合价分析1-18号元素之间具有题设条件的元素,X只可能为Na、Y为O。
答案:A
9.某元素原子的最外层电子数是次外层的a倍(a>1),则该原子的核内质子数是( )
A.2a+2 B.2a+10
C.a+2 D.2a
解析:最外层电子数大于次外层电子数,则该元素位于第二周期。
答案:A
8.(2009·潍坊统考)核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象( )
A.18O 31P B.19F 12C
C.元素周期表中ⅢA族所有元素的原子 D.元素周期表中第三周期元素的所有原子
解析:理解好题目信息是解题的关键,质子数或中子数是奇数的可用于核磁共振,知C项第ⅢA族元素的原子质子数一定为奇数,所以选C。
答案:C
7. YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于Y的说法不正确的是( )
A.属于金属元素 B.质子数与中子数之差为50
C.原子的核外电子数是39 D. Y和 Y是两种不同的核素
解析:Y元素为39号元素,39-18=21,21-18=3显然位于第五周期ⅢB族。原子 Y中含有39个质子、39个电子、50个中子。选项B不正确。
答案:B
6.关于同一种元素的原子或离子,下列叙述正确的是( )
A.原子半径比阴离子半径小
B.原子半径比阴离子半径大
C.原子半径比阳离子半径小
D.带正电荷多的阳离子半径比带正电荷少的阳离子半径大
解析:同种元素的阴离子半径大于原子半径,如r(Cl-)>r(Cl);同种元素的原子半径大于阳离子半径,如r(Na)>r(Na+);同一种元素的阳离子,电荷越多,半径越小,如
r(Fe3+)<r(Fe2+)。
答案:A
5.同温、同压下,等容积的两个密闭集气瓶中分别充满12C18O和14N2两种气体。关于这两个集气瓶中气体的说法正确的是( )
A.质子数相等,质量不等 B.分子数和质量分别不相等
C.分子数、质量分别相等 D.原子数、中子数和质子数都分别相等
解析:由阿伏加德罗定律知,两瓶中气体的分子数相同,而等物质的量的12C18O和14N2:(1)质量不等,因摩尔质量:M(12C18O)=30 g·mol-1、M(14N2)=28 g·mol-1;(2)质子数相等:12C18O的质子数=6+8,14N2的质子数=7×2;(3)原子数相等:均为双原子分子;(4)中子数不等:12C18O的中子数=6+10,14N2的中子数=7×2。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com