
题目列表(包括答案和解析)
15.在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s)
 Ca(OH)2(aq)
Ca(OH)2(aq) 
 Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是( )
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是( )
A.n(Ca2+)增大 B.c(Ca2+)不变 C.n(OH-)增大 D.c(OH-)增大
解析:当向悬浊液中加入少量生石灰时,会发生:CaO+H2O===Ca(OH)2,原饱和溶液中溶剂H2O减少,Ca(OH)2会有部分从溶液中析出形成沉淀,故n[Ca(OH)2]减少,A、C错误,但在一定温度下Ca(OH)2的溶解度不变,其浓度不变,故B正确。
答案:B
14.往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。则原溶液中c(I-)/c(Cl-)的比值为( )
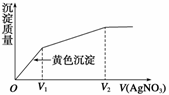
A.(V2-V1)/V1 B.V1/V2
C.V1/(V2-V1) D.V2/V1
解析:从图像变化情况看,O―→V1主要是生成AgI沉淀,V1―→V2段主要是生成AgCl沉淀,所以溶液中c(I-)/c(Cl-)=。
答案:C
13. 有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去盐酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
解析:Ba(OH)2、NaOH为强碱,pH相同即c(OH-)相同耗用等体积的盐酸,NH3·H2O为弱碱,中和时会继续电离消耗盐酸多。
答案:C
11.室温下,在pH=11的某溶液中,由水电离的c(OH-)可能为( )
①1.0×10-7 mol·L-1 ②1.0×10-6 mol·L-1
③1.0×10-3 mol·L-1 ④1.0×10-11 mol·L-1
A.③ B.④ C.①③ D.③④
解析:pH=11即c(OH-)=10-3 mol·L-1是碱性溶液,碱性溶液有两种情况:一是碱溶液,一是强碱弱酸盐的溶液。解此题要注意一个关键问题,由水电离出的c(H+)始终等于由水电离出的c(OH-)。若为碱溶液,由水电离出的c(OH-)=c(H+)==10-11 mol·L-1;
若为强碱弱酸盐的溶液,由水电离出的c(OH-)=10-3 mol·L-1。
答案:D
10.对于难溶盐MX,其饱和溶液中M+和X-的物质的量浓度之间的关系类似于[H+]·[OH-]=KW,存在等式[M+]·[X-]=Ksp。现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是( )
①20 mL 0.01 mol·L-1KCl溶液 ②30 mL 0.02 mol·L-1CaCl2溶液
③40 mL 0.03 mol·L-1HCl溶液 ④10 mL蒸馏水 ⑤50 mL 0.05 mol·L-1AgNO3溶液
A.①>②>③>④>⑤ B.④>①>③>②>⑤
C.⑤>④>②>①>③ D.④>③>⑤>②>①
解析:AgCl(s) 
 Ag+(aq)+Cl-(aq),由于[Ag+]·[Cl-]=Ksp,c(Cl-)或c(Ag+)越大,越能抑制AgCl的溶解,AgCl的溶解度就越小。注意AgCl的溶解度大小只与溶液中Ag+或Cl-的浓度有关,而与溶液体积无关。
Ag+(aq)+Cl-(aq),由于[Ag+]·[Cl-]=Ksp,c(Cl-)或c(Ag+)越大,越能抑制AgCl的溶解,AgCl的溶解度就越小。注意AgCl的溶解度大小只与溶液中Ag+或Cl-的浓度有关,而与溶液体积无关。
①中c(Cl-)=0.01 mol·L-1
②中c(Cl-)=0.04 mol·L-1
③中c(Cl-)=0.03 mol·L-1
④中c(Cl-)=0 mol·L-1
⑤中c(Ag+)=0.05 mol·L-1
Ag+或Cl-浓度由小到大的顺序为④<①<③<②<⑤,故AgCl的溶解度由大到小的排列顺序为④>①>③>②>⑤。
答案:B
9.某化工厂在生产过程中产生的废水检测指标为:pH=9-11,悬浮物1 000 mg·L-1,色度深。若对该厂废水进行处理,其中有一步操作需要加入某种物质将废水调至中性,该物质应是( )
A.氨水 B.盐酸 C.碳酸钠 D.氯化钠
解析:由题意知,此废水呈碱性,欲调至中性,只有加入盐酸,因为氨水、碳酸钠溶于水,溶液呈碱性,氯化钠溶于水,溶液呈中性。
答案:B
8. 常温下,用0.1 mol·L-1的HCl溶液滴定a mL NaOH稀溶液。反应恰好完全时,消耗HCl溶液b mL。此时溶液中氢氧根离子的浓度c(OH-)是( )
A.1×10-7 mol·L-1 B.1×107 mol·L-1
C.0.1b/a mol·L-1 D.0.1b/(a+b) mol·L-1
解析:由于此题是酸碱中和滴定,且是一元强酸与一元强碱的中和,当恰好完全反应时,溶液的pH为7,溶液呈中性,常温下c(H+)=c(OH-)=1×10-7 mol·L-1,故选A。
答案:A
7.将pH为5的硫酸溶液稀释500倍,稀释后溶液中c(SO)∶c(H+)约为( )
A.1∶1 B.1∶2 C.1∶10 D.10∶1
解析:pH=5的硫酸溶液中,c(H+)=10-5mol·L-1,c(SO)=5×10-6mol·L-1。将此溶液稀释500倍后,稀释液中c(SO)=1×10-8mol·L-1,而c(H+)趋近于1×10-7mol·L-1,则c(SO)∶c(H+)约为1∶10。故选C。本题若不能很好地理解酸、碱溶液稀释的pH计算,则很容易误选B。
答案:C
6.(2008·全国理综Ⅱ,7)实验室现有3种酸碱指示剂,其pH变色范围如下
甲基橙:3.1-4.4 石蕊:5.0-8.0 酚酞:8.2-10.0
用0.100 0 mol/L NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是( )
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
解析:NaOH溶液和CH3COOH溶液恰好反应生成CH3COONa时,CH3COO-水解显碱性,而酚酞的变色范围为8.2-10.0,比较接近。因此答案为D。
答案:D
5.下图是向100 mL的盐酸中逐渐加入NaOH溶液时,溶液的pH变化图像,根据如图所得结论正确的是( )
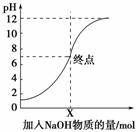
A.原来盐酸的物质的量浓度为0.1 mol·L-1
B.X为0.1 mol·L-1的NaOH溶液
C.原来盐酸的物质的量浓度为1 mol·L-1
D.X为0.01 mol·L-1的NaOH溶液
解析:原盐酸的pH=1,则c(HCl)=0.1 mol·L-1,A正确。若加入的NaOH溶液的量为无限多时,原盐酸溶液的量可以忽略不计,c(NaOH)=0.01 mol·L-1,题目中没说明NaOH的用量只能理解为c(NaOH)>0.01 mol·L-1。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com