
题目列表(包括答案和解析)
5.已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO浓度随时间变化关系如右图[饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1]。若t1时刻在上述体系中加入100 mL 0.020 mol·L-1 Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO浓度随时间变化关系的是( )
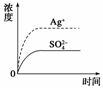
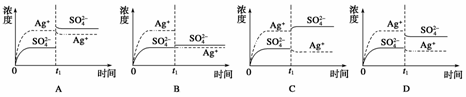
解析:当Ag2SO4刚好溶解为100 mL的饱和溶液时,c(Ag+)=0.034 mol·L-1,c(SO)=
4.下列说法正确的是( )
A.难溶电解质的溶度积Ksp越小,则它的溶解度越小
B.任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp表示
C.溶度积常数Ksp与温度有关,温度越高,溶度积越大
D.升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度是减小的,Ksp也变小
解析:本题易错选A或B。同类型的难溶电解质Ksp越小,溶解度越小,不同类型的电解质无法由溶度积比较溶解度大小,如CuS与Ag2S,故A错;B选项错在“任何难溶物”,而不是“难溶电解质”。
答案:D
3.一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.100 0 mol/L的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol/L)为( )
提示:①H2C2O4是二元弱酸
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4===8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.008 889 B.0.080 00 C.0.120 0 D.0.240 0
解析:可设NaOH溶液体积为1 L,则KMnO4溶液体积为 L,n(NaOH)=0.100 0 mol/L×
1 L=0.1 mol,n(KHC2O4·H2C2O4·2H2O)=n(NaOH)=×0.1 mol= mol
n(KMnO4)=·n(KHC2O4·H2C2O4·2H2O)=· mol= mol
c(KMnO4)==0.080 00 mol/L
答案:B
2.某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合后pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为( )
A.V(酸)=102V(碱) B.V(碱)=102V(酸)
C.V(酸)=2V(碱) D.V(碱)=2V(酸)
解析:强酸中c(H+)=10-a mol·L-1,强碱中c(OH-)= mol·L-1=10-14+b mol·L-1=
10-14+12-a mol·L-1=10-2-a mol·L-1,混合后pH=7,即n(H+)=n(OH-),故V(碱)=102V(酸)。
答案:B
1. 实验中许多量器的结构不一样,使用时要先了解其构造特点,才能尽可能地减少误差,晓明同学用某种仪器量取液体体积时,平视时读数为n mL,仰视时读数为x mL,俯视时读数为y mL,若x>n>y,请你判断她所用的仪器是( )
A.量筒 B.滴定管 C.容量瓶 D.以上均不对
解析:仰视时读数在平视时读数的下面。量筒0刻度(无)在最下边,x<n。滴定管0刻度在最上面,x>n>y。
答案:B
17.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
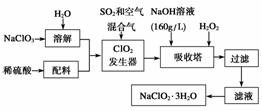
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;③HClO2可看成是强酸。
(1)160 g/L NaOH溶液的物质的量浓度为__________,若要计算该溶液溶质的质量分数,还需要的一个条件是_______________________________________________________。
(2)在发生器中鼓入空气的作用可能是________(填序号)。
A.将SO2氧化成SO3,增强酸性
B.稀释ClO2以防止爆炸
C.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为________________________________________________________________________,
吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式:________________________________________________________________________
________________________________________________________________________。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单的实验方法是____________________________________________________。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是______(填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.PbO(悬浊液)
(6)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是____________(填序号)
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
要得到更纯的NaClO2·3H2O晶体必须进行的操作是________(填操作名称)。
解析:(1)160 g/L NaOH溶液表示的是1 L溶液中含有NaOH的质量是160 g,NaOH的物质的量是4 mol,所以此溶液的物质的量浓度是4 mol/L,若要计算该溶液的质量分数 ,需要知道溶液的质量,所以还需要的条件是溶液的密度。
(2)根据题给信息,纯ClO2易分解爆炸,由此可判断发生器中鼓入空气的作用是稀释ClO2以防止爆炸。
(3)通过吸收塔内的反应制备NaClO2,ClO2是氧化剂,H2O2是还原剂,相应的氧化产物应是氧气,同时参加反应的还有NaOH,此反应的化学方程式应为:2NaOH+2ClO2+H2O2===2NaClO2+2H2O+O2;H2O2分解的化学方程式为2H2O22H2O+O2↑。
(4)判断NaOH是否过量可以采用测定溶液pH的方法。
(5)本实验的目的是制备纯净的亚氯酸钠(NaClO2),制备过程中选取的还原剂不能引入杂质,H2O2相应的产物是H2O和氧气,没有引入杂质。分析选项,Na2O2相应的产物是NaOH和氧气,不会引入杂质,PbO(悬浊液)相应的产物是PbO2固体,过滤可以除去。B、C都会引入杂质。
(6)从滤液中得到粗晶体的步骤是蒸发、冷却结晶和过滤,或者直接冷却结晶、过滤。由粗晶体制得纯的晶体,则需要重结晶。
答案:(1)4 mol/L 该溶液的密度 (2)B
(3)2NaOH+2ClO2+H2O2===2NaClO2+2H2O+O2 2H2O22H2O+O2↑ (4)连续测定吸收塔内溶液的pH (5)AD (6)BED或ED 重结晶
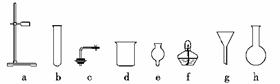
16. (1)在没有现成的CO2气体发生器的情况下,请你选用下图中的部分仪器,装配成一个简易的、能随开随用、随关随停的CO2气体发生装置,应选用的仪器是(填入编号)________;
(2)若用上述发生装置制取CO2气体,而实验室只有稀硫酸、浓硝酸、水、块状纯碱、块状大理石,设计比较合理的方案,应选用的药品是__________。
解析:(1)本题实质是考查考生是否掌握启普发生器的反应物质,用干燥管、烧杯和单孔塞组合,可以取代启普发生器中的“球形漏斗”和“容器”这两个核心部分,从而达到随关随停的目的。
(2)选用试剂时要注意,题目没有提供学生熟悉的盐酸,而硫酸会与大理石生成CaSO4沉淀,包在其表面阻止CaCO3继续和酸作用产生CO2;块状Na2CO3遇酸会溶解,使制气装置起不到随关随停的作用,本题只能选用大理石、浓硝酸和水。
答案:(1)a、c、d、e (2)浓硝酸、水、块状大理石
15.(2008·四川理综,26)某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4、Ba(NO3)2、AgNO3和CuSO4。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”)。
(1)将少许混合物放入水中得到无色溶液和白色沉淀。
|
肯定存在的物质 |
肯定不存在的物质 |
理 由 |
|
|
|
|
(2)取溶液进行焰色反应,火焰呈黄色。
|
肯定存在的物质 |
肯定不存在的物质 |
理 由 |
|
|
|
|
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
|
肯定存在的物质 |
肯定不存在的物质 |
理 由 |
|
|
|
|
(4)通过上述实验仍无法确定的物质是________________________________________________________________________。
解析:(1)根据无色溶液,可判断一定无CuSO4,因为CuSO4溶液为蓝色。
(2)根据焰色反应呈黄色,则判断一定有Na2SO4,不能确定其他的物质是否存在。
(3)与盐酸反应放出气体,且沉淀完全溶解,因此一定有MgCO3,一定无Ba(NO3)2和AgNO3,若有这两种物质,会生成不溶于盐酸的沉淀。
答案:(1)
|
无 |
CuSO4 |
溶液无色,而CuSO4溶液为蓝色 |
(2)
|
Na2SO4 |
无 |
钠的焰色反应呈黄色 |
(3)
|
MgCO3 |
Ba(NO3)2、 AgNO3 |
MgCO3沉淀溶于稀盐酸,有气体放出;如有Ba(NO3)2,生成的BaSO4沉淀不溶于盐酸;如有AgNO3,生成的沉淀在盐酸中不消失 |
(4)Al2(SO4)3
14.在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径:
(1)FeH2Cu
(2)CuOCuSO4Cu
若用这两种方法制得等量的铜,则下列有关说法符合实际情况的是( )
A.消耗氧化铜的质量相同 B.消耗铁的质量相同
C.消耗硫酸的质量相同 D.生成硫酸亚铁的质量相同
解析:此题的关键问题在于实际操作中的注意事项。制备1 mol Cu需1 mol CuO,而H2还原时由于排空气、冷却,因此需要远大于1 mol H2的量,即消耗的Fe、H2SO4及生成的FeSO4均多。
答案:A
13.可用下图装置制取(必要时可加热)、净化、收集的气体是( )
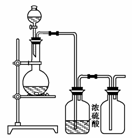
A.铜和稀硝酸制一氧化氮
B.氯化钠与浓硫酸制氯化氢
C.锌和稀硫酸制氢气
D.硫化亚铁与稀硫酸制硫化氢
解析:从题给的装置看所得气体应具备下列特点:①可用浓H2SO4干燥(即不与浓H2SO4反应),②能用排空气法收集且密度比空气大(从收集装置进气管看),因此应选B。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com