
题目列表(包括答案和解析)
1.(2010×河北孝感市调研)观察下列模型,其中只有C、H、O三种原子,下列说法正确的是( )

A.模型1对应的物质含有双键
B.模型2对应的物质具有漂白性
C.模型1对应的物质可与模型3对应的物质发生酯化反应
D.模型3、模型4对应的物质均具有酸性,且酸性4强于3
解析:首选观察、分析出“小白球”代表氢原子,“灰色球”代表C原子,“黑球”代表
氧原子。其次可以分析出模型所代表的物质分别为:CH3OH、HCHO、HCOOH、H2CO3。
第三逐个选项分析,只有C项说法正确。
答案:C
FeCl3与KSCN溶液反应
|
编号 |
混合溶液颜色 |
滴加的溶液 |
溶液颜色的变化 |
平衡移动的方向 |
|
1 |
橙红色 |
FeCl3 |
①颜色____了,由橙红色变成了____色 |
③向____移动 |
|
2 |
橙红色 |
KSCN |
②颜色____了,由橙红色变成了____色 |
④向____移动 |
|
3 |
橙红色 |
KCl |
颜色变浅了,由橙红色变成了黄色 |
⑤向____移动 |
|
4 |
橙红色 |
NaF |
颜色变浅了,由橙红色变成了无色 |
⑥向____移动 |
|
5 |
橙红色 |
- |
橙红色 |
不移动 |
(1)由①②现象说明假设________成立,假设________不成立。
(2)根据Fe3++SCN- Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是
。
Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是
。
(3)根据“4”号试管中的现象,分析在4号试管中发生的变化是________________________________________________________________________,
说明了 。
(从改变浓度影响平衡移动角度回答)
解析:FeCl3与KSCN发生的化学反应为:
FeCl3+3KSCN Fe(SCN)3+3KCl,Fe3++3SCN-
Fe(SCN)3+3KCl,Fe3++3SCN- Fe(SCN)3。加入FeCl3或KSCN(增大反应物浓度)会使平衡向右移动,颜色加深,加入KCl固体,颜色变浅,说明平衡向左移动,可能是加入的Cl-与Fe3+形成配离子,减小了Fe3+的浓度。加入NaF溶液变为无色,说明F-与Fe3+形成了比Fe(SCN)3更稳定的配位化合物,使平衡向左移动。
Fe(SCN)3。加入FeCl3或KSCN(增大反应物浓度)会使平衡向右移动,颜色加深,加入KCl固体,颜色变浅,说明平衡向左移动,可能是加入的Cl-与Fe3+形成配离子,减小了Fe3+的浓度。加入NaF溶液变为无色,说明F-与Fe3+形成了比Fe(SCN)3更稳定的配位化合物,使平衡向左移动。
答案:①加深 红 ②加深 红 ③右 ④右 ⑤左 ⑥左 (1)1 2 (2)Fe3+与Cl-形成络离子,使Fe3+浓度减小,平衡向左移动 (3)F-与Fe3+形成了无色的且比Fe(SCN)3更稳定的化合物(络合物) 减小反应物的浓度会使平衡向逆反应方向移动。
(1)往250 mL烧杯中加入100 mL蒸馏水,然后加入10 mL 0.01 mol/L FeCl3溶液,再加入10 mL 0.01 mol/L KSCN溶液,溶液由黄色变成橙红色。
(2)取5支试管,编号分别为1,2,3,4,5,然后各取步骤(1)中FeCl3和KSCN的混合溶液4 mL加到5支试管中。往1号试管中滴加2-3滴1.0 mol/L FeCl3溶液,振荡,观察现象;往2号试管中滴加2-3滴1.0 mol/L KSCN溶液,振荡,观察现象;往3号试管中加入少量KCl固体,振荡,观察现象;往4号试管中滴加2-3滴1.0 mol/L NaF溶液,振荡,观察现象。
试剂:FeCl3(aq)(0.01 mol/L,1.0 mol/L),KSCN(aq)(0.01 mol/L,1.0 mol/L ),KCl(s),NaF(aq)(1.0 mol/L)。
15.(2010·模拟题)在100 mL NaOH溶液中加入NH4NO3和(NH4)2SO4固体混合物,加热充分反应。如图表示加入的混合物的质量和产生的气体体积(标准状况)的关系。试计算:
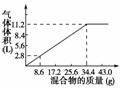
(1)NaOH溶液的物质的量浓度为________mol/L。
(2)当NaOH溶液的体积为140 mL,固体混合物的质量是51.6 g时,充分反应后,生成气体的体积(标准状况)为________L。
(3)当NaOH溶液的体积为180 mL,固体混合物的质量仍为51.6 g时,充分反应后,生成气体的体积(标准状况)为________L。
解析:(1)由图知34.4 g混合物和100 mL NaOH恰好完全反应。
因为1 mol NaOH-1 mol NH3,即n(NaOH)=n(NH3)=11.2 L/22.4 L·mol-1=0.5 mol,c(NaOH)=n/V=0.5 mol/0.100 L=5 mol·L-1。
(2)由图可得V(NaOH)=140 mL时,消耗固体混合物的质量为×140=48.16(g),所以固体混合物过量。所以V(气)=22.4×n(NaOH)=22.4×5×0.140=15.68(L)。
(3)由图可得V(NaOH)=180 mL时,消耗固体混合物的质量为×180=61.92(g),所以NaOH过量,用固体混合物计算。由图得出生成气体的体积为×11.2=16.8(L)。
答案:(1)5 (2)15.68 (3)16.8
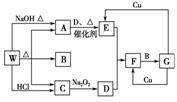
14.(2010·天津八校期中统考题)W是一种盐,它存在下列转化关系(部分产物已略去),其中A、C、D 是无色气体。
请回答下列问题:
(1)A的电子式是________________。
(2)完成下列反应的方程式,是离子反应的只写离子方程式:
A→E: __________________________________________________________;
G→E: ____________________________________________________________。
(3)E和D恰好完全反应时,得到的F常温下是混合物,原因是(结合化学方程式回答) __________。
(4)发送我国第一颗探月卫星嫦娥一号的火箭是我国自己制造的长征三号甲火箭,火箭使用的推进剂由氧化剂和还原剂组成。F中的无色物质经液化后,作为长征三号甲火箭一二级推进剂中的氧化剂。还原剂是相对分子质量为60,碳、氢、氮三种元素的质量比为6∶2∶7的液态有机物,该还原剂的化学式是________ _______;
若5 g还原剂和氧化剂完全燃烧时生成气体B、C,以及一种参与大气循环的气体,并放出212.5 kJ的热量,写出该反应的热化学方程式__________________________。
解析:W分解产生三种物质,且W能与NaOH和盐酸反应,且C能与Na2O2反应,可猜想W为NH4HCO3或(NH4)2CO3。A为NH3,B为H2O,C为CO2,CO2与Na2O2反应生成D(O2),NH3在一定条件下发生催化氧化反应生成E(NO),NO与O2反应生成F(NO2),NO2与H2O反应生成G(HNO3),浓HNO3与Cu反应生成NO2,稀HNO3与Cu反应生成NO。由于NO2和N2O4在密闭体系内存在如下反应:2NO2N2O4,所以常温下为混合物。(4)N2O4具有强氧化性,在火箭推进剂中作氧化剂,作为还原剂的有机物中n(C)∶n(H)∶n(N)=∶∶=1∶4∶1,再根据其相对分子质量可得该有机物的分子式为C2H8N2。C2H8N2(l)与N2O4(l)反应生成CO2(g)、H2O(g)、N2(g),1 mol C2H8N2(l)反应放出的热量为×212.5 kJ=2 550 kJ,再根据热化学方程式书写原则,即可写出C2H8N2(l)与N2O4(l)反应的热化学方程式。
答案:(1)H··H···· ··H (2)4NH3+5O2催化剂△4NO+6H2O
3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O
(3)2NO N2O4,二氧化氮与四氧化二氮之间存在化学平衡,二氧化氮和四氧化二氮共存
N2O4,二氧化氮与四氧化二氮之间存在化学平衡,二氧化氮和四氧化二氮共存
(4)C2H8N2 C2H8N2(l)+2N2O4(l)===2CO2(g)+4H2O(g)+3N2(g);ΔH=-2 550 kJ/mol
13.(2010·天津八校期中统考题)某校学生利用以下装置验证氯气与氨气之间的反应(部分装置已略去)。其中A、B分别为氯气和氨气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
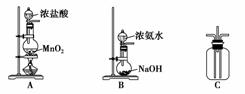
请完成下列问题:
(1)装置A中发生反应的离子方程式为_________________________ __________。
(2)装置B中浓氨水与NaOH固体混合可制取氨气,其原因是_________________。
(3)装置C中氯气和氨气相遇,有浓的白烟并在容器内壁凝结,同时生成一种可参与生态循环的无毒气体,该反应的化学方程式为________________________,此反应可用于检查输送氯气的管道是否漏气。
(4)将装置C中反应生成的固体溶于水,所得溶液中离子浓度由大到小的顺序为___。
解析:(3)问,从所含元素化合价的可变性考虑,NH3具有还原性,Cl2具有强氧化性,进一步结合两者反应时有浓的白烟生成,且白烟能在容器内壁凝结,可推断反应生成了NH4Cl。根据同时生成了一种可参与生态循环的无毒气体,可知产物中含有N2。综合以上分析,可写出NH3与Cl2反应的化学方程式为:8NH3+3Cl2===6NH4Cl+N2。(4)问,固体NH4Cl溶于水,首先发生电离:NH4Cl===NH4++Cl-,产生等量的NH4+和Cl-,其中的NH4+在随后发生的水解中消耗了一部分,决定了溶液中离子浓度由大到小的顺序是
c(Cl-)>c(NH4+)>c(H+)>c(OH-)。
答案:(1)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
(2)在氨水中有下列平衡:NH3+H2O NH3·H2O
NH3·H2O NH4++OH-,NaOH固体溶于水放热,使得氨气的溶解度减小,同时增大了溶液的c(OH-),促使化学平衡逆向移动
NH4++OH-,NaOH固体溶于水放热,使得氨气的溶解度减小,同时增大了溶液的c(OH-),促使化学平衡逆向移动
(3)3Cl2+8NH3===6NH4Cl+N2
(4)c(Cl-)>c(NH4+)>c(H+)>c(OH-)
12.(2010·模拟题)某课外活动小组利用下图所示仪器装置和药品进行物质性质与转化关系的探究。当将Ⅱ中铂丝加热至红热时,打开K阀使气流缓缓通过。
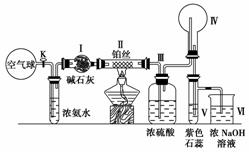
请回答下列有关问题:
(1)如何检查该装置的气密性:___________ _______________________________。
(2)写出Ⅱ中发生反应的化学方程式:_______ _____________________________。
(3)装置Ⅳ(烧瓶)中的现象:________________________________________________;
装置Ⅴ(试管)中的现象:__________________________________________________。
(4)装置Ⅰ与Ⅲ都能起到干燥气体的作用,两者能否调换位置使用:________(填“能”或“不能”);理由____ ____________________________________。
(5)烧杯中NaOH溶液的作用:_____________________________________________。
解析:根据仪器和药品,首先确定该套实验装置是用来完成氨气的催化氧化实验并验证NO、NO2的性质。其次分析出每种仪器的作用和实验步骤,利用空气球提供O2,赶出浓氨水中的NH3,浓氨水吸收空气中的CO2并且提供NH3,碱石灰是吸收CO2及NH3中的H2O(气),Ⅱ是NH3催化被氧化,Ⅲ吸收H2O及未反应的NH3,Ⅳ是冷却后观察NO与O2的反应且观察NO2能使Ⅴ中的溶液变红;Ⅵ吸收NO和NO2。
答案:(1)打开K阀,观察Ⅵ处有无气泡产生(或微热Ⅱ处,观察Ⅵ处有无气泡)
(2)4NH3+5O2Pt△4NO+6H2O
(3)产生红棕色气体 紫色石蕊试液变红
(4)不能 浓H2SO4吸收氨气,使后继反应不能进行,碱石灰也吸收NO2气体
(5)吸收尾气,防止NO、NO2污染空气
11.(2010·安徽师大附中月考题)如图所示“合成氨”的演示实验(夹持仪器均已省略)。在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,另一侧用NaNO2固体和 NH4Cl饱和溶液反应制取N2,N2和H2混合后通过还原铁粉来合成了NH3,再将产生的气体通入酚酞试液中,若酚酞试液变红,则说明产生了氨气。
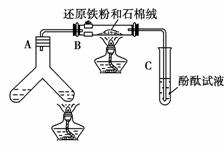
某课外活动小组通过查阅资料和多次实验,得到了如下信息:
信息一:NaNO2固体和饱和NH4Cl溶液混合加热的过程中发生如下反应:
①NaNO2+NH4Cl===NH4NO2+NaCl ②NH4NO2===NH3+HNO2
③2HNO2===N2O3+H2O ④2NH3+N2O3===2N2+3H2O
信息二:查阅资料,不同体积比的N2、H2混合气体在相同实验条件下合成氨,使酚酞试液变红所需要的时间如下:

N2和H2的体积比,5∶1,3∶1,1∶1,1∶3,1∶5
酚酞变红色所需时间/min,8-9,7-8,6-7,3-4,9-10据此回答下列问题:
(1)Y形管左侧管中发生反应的离子方程式__________________________________。
(2)铁粉撒在石棉绒上的目的是_____________________________________________。
(3)课外活动小组的同学们认为,该实验中即使酚酞变红也不能说明N2和H2反应合成了NH3,得出此结论的理由是______ __________________________________,
请你另设计一个简单的实验验证你的理由___________________________________。
欲解决这一问题,可以选用下图中的________装置连接在原装置中的________和
_ __之间。

(4)在上述实验过程中,为尽快观察到酚酞试液变红的实验现象,应该控制N2和H2:的体积比为
_______比较适宜;但该装置还难以实现此目的,原因是_______________ _______。
(5)实验过程中通入试管C中的气体成分有___________________________________。
解析:(1)根据Y形管右侧管需加热,说明右侧管反应制取N2,左侧管反应制取H2。(2)铁粉撒在石棉绒上的目的是增大与混合气体的接触面积,从而提高催化效率,增大反应速率。(3)因为NH4NO2分解可产生NH3,所以不能证明N2和H2反应生成了NH3。
答案:(1)Zn+2H+===Zn2++H2↑
(2)增大混合气体与催化剂的接触面积,使反应进行得更快
(3)从分步反应可知,产生N2的过程中,有可能直接产生氨气 将混合物加热产生的气体直接通入酚酞试液,若试液变红,则说明理由成立,否则,说明理由不成立 ③ A B (4)1∶3 无法控制通入B中N2和H2的体积比
(5)NH3、N2、H2
10.(2010·西安十中期中考题)将足量NH3通入HNO3和AgNO3的混合稀溶液中,生成沉淀的物质的量(n)和通入NH3的体积(V)的关系正确的是 ( )

解析:本题需要运用氨气与硝酸和硝酸银溶液反应的知识。向混合溶液中通入氨气,氨首先与硝酸发生反应生成硝酸铵,此时无沉淀生成,排除了选项B。当硝酸反应完后,继续通入的氨气与硝酸银溶液反应先生成沉淀,然后沉淀又逐渐溶解:①NH3+H2O+AgNO3===AgOH↓+NH4NO3,②2NH3+AgOH===OH-+[Ag(NH3)2]+,所以前后两个反应中消耗氨气的物质的量之比是1∶2,故选项A符合题意。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com