
题目列表(包括答案和解析)
11.将溶质的质量分数为a%、浓度为c1 mol·L-1的稀硫酸,加热蒸发掉一定量的水,使溶质的质量分数转变为2a%,此时硫酸的物质的量浓度为c2 mol·L-1。则c1与c2的关系是( )
A.c1=2c2 B.c2<2c1 C.c2>2c1 D.c2=2c1
解析:因原溶液蒸发掉一定量的水后,溶质的质量分数由a%转变成2a%,可知蒸发掉水的质量是原溶液质量的一半。而物质的量浓度由c1 mol·L-1转变为c2 mol·L-1,所以原溶液可看作是由物质的量浓度为c2 mol·L-1的溶液与水等质量混合而得,硫酸的密度是随浓度的增大而增大的溶液。故可得c1<,即c2>2c1。
答案:C
10. 在25℃时,浓度均为1 mol·L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,测得其中c(NH)分别为a mol·L-1、b mol·L-1、c mol·L-1,则下列判断正确的是( )
A.a>b>c B.c>a>b C.b>a>c D.a>c>b
解析:CO与NH相互促进水解,Fe2+与NH相互抑制水解,因此b<a<c⇒B正确。
答案:B
9.(2008·海南化学,5)设NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,5.6 L四氯化碳含有的分子数为0.25NA
B.标准状况下,14 g氮气含有的核外电子数为5NA
C.标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA
解析:A项中四氯化碳是液态物质;B项中14 g N2含有的核外电子总数为7NA;D项中每生成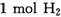 时转移的电子数为
时转移的电子数为
答案: C
8.(2008·江苏化学,3)用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 常温常压下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA
B.标准状况下,22.4 L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.1 L浓度为1 mol·L-1的Na2CO3溶液中含有NA个CO
解析:A项,Cl2小于1.5 mol;B项己烷为液体;D项CO要水解。
答案:C
7.(2008·山东理综,13)NA代表阿伏加德罗常数,下列叙述错误的是( )
A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
B.在H2O2+Cl2===2HCl+O2反应中,每生成32 g氧气,则转移2NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.一定温度下,1 L 0.50 mol·L-1 NH4Cl溶液与2 L 0.25 mol·L-1NH4Cl溶液含NH的物质的量不同
解析:设H2SO4稀释前后的密度分别为ρ1、ρ2,稀释后的质量分数为w,则w=×100%=9.8%×,H2SO4的浓度越大,密度越大,即ρ1>ρ2,则w>9.8%。
答案:A
6.下列叙述正确的是( )
A.将5.85 g NaCl晶体溶于100 mL水中,制得0.1 mol·L-1 NaCl溶液
B.将1体积c mol·L-1硫酸溶液用水稀释为5体积,得到0.2c mol·L-1硫酸溶液
C.将25 g无水CuSO4溶于水制成100 mL溶液,其浓度为1 mol·L-1
D.将w g a%NaCl溶液蒸发掉w/2 g水,得到4a%NaCl溶液
解析:本题考查了一定物质的量浓度溶液的配制、溶液计算及计算能力的应用,较难题。A项中应将5.85 g NaCl晶体配成100 mL溶液,A不正确;C项中25 g无水硫酸铜的物质的量大于0.1 mol(注意:无水硫酸铜的摩尔质量为160 g/mol);D项中得到NaCl溶液的质量分数≤2a%。
答案:B
5.等质量的CuO和MgO粉末分别溶于相同体积的硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的物质的量浓度分别为a mol·L-1和b mol·L-1。则a与b的关系为( )
A.a=b B.a=2b C.2a=b D.a=5b
解析:设m(CuO)、m(MgO)均为80 g,则:a∶b=∶=
(溶液的体积相同时,溶质的物质的量浓度之比等于其物质的量之比),即2a=b。
答案:C
4.用密度为1.32 g·mL-1的硫酸溶液逐滴滴入到BaCl2溶液中,直到恰好完全沉淀为止,已知所生成的溶液的质量等于原BaCl2溶液的质量,则硫酸的浓度为( )
A.21.9% B.42.1% C.13.5 mol·L-1 D.5.67 mol·L-1
解析:根据质量守恒定律可知,硫酸溶液的质量与生成硫酸钡沉淀的质量相等,若生成233 g沉淀,则有1 mol硫酸发生反应,其溶液的质量为233 g。
c(H2SO4)==5.67 mol·L-1 w=×100%=42.1%。
答案:BD
3.(2009·海南单科,8)下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
A.2.4 g金属镁变为镁离子时失去的电子数为0.1NA
B.1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等
C.在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10NA
D.CO和N2为等电子体,22.4 L的CO气体与1 mol N2所含的电子数相等
解析:A中应为0.2NA;B中盐酸的体积不知道,无法确定溶质的粒子数;D中22.4 L的CO的状态不确定,CO的物质的量无法确定。
答案:C
2. 配制100 mL 0.1 mol/L Na2CO3溶液,下列操作正确的是( )
A.称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B.称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C.转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D.定容后,塞好瓶塞,反复倒转,摇匀
解析:A选项错,不能在容量瓶中溶解物质;B选项错,因为要配制100 mL溶液,加入100 mL蒸馏水溶解Na2CO3所得溶液并不是100 mL;C选项未用玻璃棒引流,故C项错。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com