
题目列表(包括答案和解析)
9、1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )
A.9.0 B.9.5 C.10.5 D.11.0
8、pH=13的强碱溶液和pH=2的强酸混合,所得混合液的pH=11,则强碱与强酸的体积比是( )
A、1:9 B、9:1 C、1:11 D、11:1
7、常温时,以下4种溶液pH最小的是( )
A.0.01mol∙L-1醋酸溶液
B.0.02mol∙L-1醋酸与0.02mol∙L-1NaOH溶液等体积混合液
C.0.03mol∙L-1醋酸与0.01mol∙L-1NaOH溶液等体积混合液
D.pH=2的盐酸与pH=12的NaOH溶液等体积混合液
6、下列事实可证明氨水是弱碱的是( )
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 B.铵盐受热易分解
C.0.1mol/L氨水可以使酚酞试液变红 D.0.1mol/L氯化铵溶液的pH约为5
5.0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
4、25 ℃时,水的电离达到平衡:H2O  H+ +
OH- ;ΔH > 0 ,下列叙述正确的是( )
H+ +
OH- ;ΔH > 0 ,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,水的离子积常数不变
C.向水中加人少量固体CH3COONa ,平衡逆向移动,c(H+)降低
D.将水加热,水的离子积常数增大,pH不变
3、 室温下,0.1 mol/L的下列物质的溶液中,水的电离能力大小排列正确的是( )
① AlCl3 ② KNO3 ③ NaOH ④ NH3
A. ①>②>③>④ B. ①>②>④>③
C. ③>④>②>① D. ①=②=③=④
2、90℃时水的离子积Kw=3.8×10-13,该温度时纯水的pH值 ( )
A. 等于7 B. 小于7 C. 大于7 D. 无法确定
1、下列说法正确的是( )
A.氯气、铜、二氧化碳、氯化钠溶液这四种物质中有1种是电解质,有2种是非电解质,有1种既不是电解质也不是非电解质
B.强电解质一般易溶于水,弱电解质一般难溶于水
C.非电解质溶液中也可能存在电离平衡
D.强酸强碱盐溶液一定显中性
8.电解质的溶解性与电解质强弱的关系
电解质的溶解性是根据在20℃时其溶解度来确定的,而电解质的强弱是按其在水中的电离程度来分的,两者无必然联系。如BaSO4难溶于水却是强电解质,溶解平衡表达式:Ba2SO4 (s)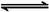
 Ba2+(aq)+
Ba2+(aq)+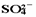
 (aq)。
(aq)。
电离方程式:Ba2SO4===Ba2++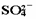
 。
。
判断某一元酸为弱电解质的方法:
(1)测定同温度、同浓度一元强酸与一元弱酸的pH,一元弱酸的pH大。
(2)测定同温度、同浓度强酸盐和弱酸盐的水溶液的pH,弱酸盐pH大。
(3)配制同温度、同浓度的一元强酸与一元弱酸溶液做导电性实验,弱酸导电性差。
(4)测定1 mol·L-1该弱酸溶液,其pH>0。
(5)取同温度、同pH强酸和弱酸溶液稀释相同倍数测pH,pH较小者为弱酸。
专题训练
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com