
题目列表(包括答案和解析)
14.科学家们在探索生命奥秘的过程中,认识到生命细胞的组成和元素周期律有着密切的联系,约占人体总质量99.97%的11种大量元素全部是元素周期表前20号元素,其余0.03%是由10多种人体不可缺少的微量元素组成。现有a-h 8种短周期元素,是除氧、钾、钙外的其他大量元素,它们在元素周期表中的位置如下,请据此回答下列问题:
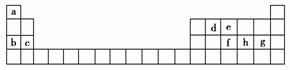
(1)下列元素的原子间反应最容易形成离子键的是________,容易形成共价键的是________。
A.c和f B.b和g
C.d和g D.b和e
(2)下列由a-g形成的各分子中所有原子都满足最外层为8电子结构的是________。
A.ea3 B.ag
C.fg3 D.dg4
(3)均由a、b、h和氧四种元素形成的两种离子化合物,相互反应可生成有刺激性气味的气体。这两种化合物中有一种式量为120,该化合物熔化时破坏的是________(填化学键类型,下同),溶于水时破坏的是________________。
[解析] 由元素在周期表中的位置可推知:a为H,b为Na,c为Mg,d为C,e为N,f为P,g为Cl,h为S。
(1)非金属性最强的Cl和金属性最强的Na最易形成离子键,故选B。非金属元素间易形成共价键,而四个组合中只有碳、氯完全为非金属元素,故选C。
(2)写出各选项所对应的分子,其中NH3和HCl中的氢不是8电子结构,只有C、D符合题意。
(3)均由H、Na、S、O四种元素构成的能相互反应的离子化合物猜测是NaHSO3和NaHSO4,其中式量为120的为NaHSO4,熔化时破坏的是离子键,电离方程式为:NaHSO4===Na++HSO;溶于水时破坏的是离子键和共价键:NaHSO4===Na++H++SO。
[答案] (1)B C (2)CD (3)离子键 离子键和共价键
13.根据元素周期表1-20号元素的性质和递变规律,回答下列问题:
(1)属于金属元素的有______种,金属性最强的元素与O2反应生成的化合物有________(填两种),这两种物质中的化学键类型分别是______________________________。
(2)属于稀有气体的是______________(填元素符号,下同)。
(3)形成化合物种类最多的两种元素是________。
(4)第三周期中,原子半径最大的是(稀有气体除外)____。
(5)Si、N最简单氢化物的稳定性________大于______(填化学式)。
[答案] (1)7 K2O K2O2 离子键、离子键、非极性键
(2)He、Ne、Ar
(3)C、H (4)Na (5)NH3 SiH4
12.短周期元素X、Y可以形成化合物XY2。下列有关叙述正确的是
( )
A.若XY2是共价化合物, 则X与Y的原子序数不可能相差1
B.若XY2是离子化合物,则X与Y的原子序数可能相差8
C.若X与Y的原子序数相差5,则离子化合物XY2不溶于水
D.若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液
[解析] 共价化合物NO2中N、O原子序数差为1,故A项不正确;短周期元素形成的离子化合物XY2中X只能显+2价,Y显-1价,Mg、Be与H、F、Cl之间原子序数之差均不会是8,故B项不正确;Mg、Be与H、F、Cl之间形成的离子化合物均溶于水或与H2O发生反应,故C项不正确;共价化合物XY2中X与Y原子序数差为6的只有SiO2,SiO2可与强碱溶液反应,故D项正确。
[答案] D
11.元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期。下列有关推测正确的是
( )
A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
B.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ2
[解析] X、Y、Z三种元素的原子序数之和为26,且Y、Z在同一周期,X、Y、Z一定为短周期元素。Y、Z同周期,YZ3可能为NO或CO。若为NO,则X为Na+(26-7-8=11);若为CO,则X为Mg2+(26-6-8=12)。A项:XYZ3不可能是酸;B项,XYZ3是微溶于水的盐,则其为MgCO3,X与Z形成MgO是离子化合物;C项:XYZ3是易溶于水的盐,则其为NaNO3,Y与Z形成NO是共价化合物;D项:XYZ3是离子化合物,可能是NaNO3或MgCO3,Y与Z形成NO2或CO2均为共价化合物。综上所述,B正确。
[答案] B
10.下列说法中正确的是
( )
A.非金属元素原子间形成的化学键一定是共价键
B.反应N2+3H2
 2NH3中每有1 mol N
2NH3中每有1 mol N N键断裂,同时有3 mol H—H键断裂时,反应达到平衡状态
N键断裂,同时有3 mol H—H键断裂时,反应达到平衡状态
C.化学反应过程中一定有新化学键的形成,形成新化学键时要释放一定的能量,所以化学反应都释放能量
D.氯化钠熔化时要破坏其中的离子键,需要较多的能量,所以氯化钠的熔点较高
[解析] A项,非金属元素原子间形成的化学键不一定是共价键,如NH4Cl中Cl-和NH之间形成的是离子键;B项,N N键的断裂以及H—H键的断裂都表示的是正反应,不能判断是否达到平衡状态;C项,化学反应吸收还是释放能量取决于旧化学键断裂吸收的能量和新化学键形成释放的能量的相对大小。
N键的断裂以及H—H键的断裂都表示的是正反应,不能判断是否达到平衡状态;C项,化学反应吸收还是释放能量取决于旧化学键断裂吸收的能量和新化学键形成释放的能量的相对大小。
[答案] D
9.初中时我们就知道,有新物质生成的反应属于化学反应,但从化学键的观点看化学反应的实质是“旧键的断裂,新键的形成”。据此你认为下列变化不属于化学反应的是(多选)
( )
A.蔗糖溶于水 B.金刚石变成石墨
C.氯化钠熔化 D.五氧化二磷吸水
[解析] 蔗糖溶于水既没有旧键的断裂,也没有新键的形成;而氯化钠熔化只有旧键的断裂,没有新键的形成,故两者都不属于化学反应。金刚石变成石墨实际上是金刚石中的碳碳键断裂,碳原子重新形成新的碳碳键而变为石墨,故属于化学变化。同理,五氧化二磷吸水变为磷酸也属于化学变化。
[答案] AC
8.下列物质的变化过程中,共价键明显被破坏的是(多选)
( )
A.I2升华
B.NaCl熔化
C.HCl溶于水得盐酸
D.从NH4HCO3中闻到了刺激性气味
[解析] A.由I2分子组成的物质的升华是物理变化,共价键未被破坏。B.NaCl是离子化合物,NaCl熔化的过程有离子键被破坏。C.HCl分子中有共价键,HCl溶于水形成盐酸的过程中有变化:HCl===H++Cl-,此变化中H—Cl共价键被破坏。
D.NH4HCO3是由NH和HCO组成的离子化合物,NH与HCO之间的化学键是离子键,NH内的有关原子之间、HCO内的有关原子之间的化学键是共价键。从NH4HCO3中闻到刺激性气味,是因为发生了化学反应:NH4HCO3===NH3↑+CO2↑+H2O。比较NH3与NH、CO2与HCO的组成可知,NH4HCO3分解的过程既有离子键被破坏,又有共价键被破坏。
[答案] CD
7.化学键使得一百多种元素构成了世界的万事万物。关于化学键的下列叙述中,正确的是(多选)
( )
A.离子化合物可能含共价键,共价化合物中不含离子键
B.共价化合物可能含离子键,离子化合物中只含离子键
C.构成单质分子的微粒一定含有共价键
D.在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用
[解析] 依据概念分析选项。
(1)含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,A项正确,B项错误。
(2)稀有气体分子内不含化学键,C项错误。
(3)化学键是原子或离子之间的强相互作用,既有静电吸引,又有静电排斥,D项正确。
[答案] AD
6.下列分子中所有原子都满足最外层8个电子结构的是
( )
A.光气(COCl2) B.六氟化硫
C.二氟化氙 D.三氟化硼
[解析] 逐项分析列表如下:
|
|
A |
B |
C |
D |
|
成键原子最外层电子数 |
C:|+4|+4=8 O:|-2|+6=8 Cl:|-1|+7=8 |
S:|+6|+6=12 F:|-1|+7=8 |
Xe:|+2|+8=10 F:|-1|+7=8 |
B:|+3|+3=6 F:|-1|+7=8 |
[答案] A
5.短周期元素E的氯化物ECln的熔点为-78 ℃,沸点为59 ℃;若0.2 mol ECln与足量的AgNO3溶液完全反应可得到57.4 g AgCl沉淀。下列判断错误的是
( )
A.E是一种非金属元素
B.在ECln中E与Cl之间形成共价键
C.E的一种氧化物为EO2
D.E位于元素周期表的ⅣA族
[解析] E为硫元素,ECln为SCl2。
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com