
题目列表(包括答案和解析)
2. 下列所述变化规律正确的是( )
A. Na、Mg、Al还原性依次增强
B. HCl、PH3、H2S稳定性依次减弱
C. NaOH、KOH、CsOH碱性依次减弱
D. S2-、Cl-、K+、Ca2+离子半径依次减小
1. 根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
A. 铍(Be)的原子失电子能力比镁弱
B. 砹(At)的氢化物不稳定
C. 硒(Se)化氢比硫化氢稳定
D. 氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强
18. 下表为元素周期表的一部分,请回答有关问题:
|
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
|
③ |
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)⑤和⑧的元素符号是 和 。
(2)表中最活泼的金属是 ,非金属性最强的元素是 。(填写元素符号)
(3)表中能形成两性氢氧化物的元素是,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式: ,
。
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:
第二节 元素周期律
17. 问题:卤素是一典型非金属元素,你能设计合理方案研究其元素性质的递变规律吗?
某学生做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象。请你帮助学生整理并完成实验报告。
(1)实验目的: 。
(2)实验用品:
仪器:① ;② 。(请填写两种主要玻璃仪器)
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳。
(3)实验内容(在下列空格内填写相关内容):
|
序号 |
实验方案 |
实验现象 |
|
① |
|
|
|
② |
|
|
(4)实验结论: 。
(5)问题和讨论:
①请用物质结构理论简单说明得出上述结论的原因:
。
②由于F2过于活泼,很难设计一个简单的实验验证其氧化性的强弱。试列举两个事实说明F的非金属性比Cl强:
。
16. 元素周期表中六种元素①②③④⑤⑥位置如下所示:
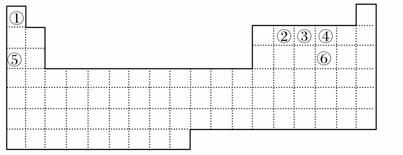
回答下列问题:
(1)由②④⑤三种元素组成的无机物(相对分子质量为106),其水溶液呈碱性,用离子方程式表示其原因 。
(2)只含①③④三种元素的一种常见离子化合物中,元素③的化合价分别处于最高价和最低价,则其水溶液中离子浓度由大到小的顺序为 。
(3)元素③的氢化物与元素④的单质在一定条件下发生置换反应,在该反应中氧化剂与还原剂的物质的量之比为 。
(4)用惰性电极电解元素⑥的最高价氧化物对应水化物的稀溶液,阳极的电极反应式为 。
15. 短周期元素X的氧化物、氢氧化物既能与强酸反应又能与强碱反应,其核外电子总数是内层电子总数的2倍;短周期元素Y的氢化物的浓的水溶液可与含Y的钾盐(KYO3)反应生成Y元素的单质,Y单质有毒,试根据以上信息完成下列问题:
(1)写出X与Y形成的化合物的化学式 。
(2)写出X的氧化物与Y的氢化物的水溶液反应的离子方程式 。
(3)X的氧化物、氢氧化物所具备的特殊性质与另外一种与Y同周期的元素的氧化物、氢氧化物的性质相似,它们之所以相似,与它们在周期表中的相互位置有关,则下面说法合理的是 (填字母)。
A. 它们处于同一主族,故性质相似
B. 它们处于同一周期,并且相邻,故性质相似
C. 它们处于对角线的位置,故性质相似
D. 它们的最外层电子数都较少,故性质相似
14. 下表是元素周期表主族元素的一部分
|
W |
X |
Y |
|
|
|
Z |
短周期元素X的最高正价是+5价,Y单质可在空气中燃烧。
(1)Z的元素符号是 ,原子结构示意图为 。
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,反应的化学方程式为 。
(3)探寻同一主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式。
|
编号 |
性质推测 |
化学方程式 |
|
示例 |
氧化性 |
H2ZO3+4HI=Z↓+2I2+3H2O |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
13. (2009年高考广东卷·理基)下表是元素周期表的一部分,有关说法正确的是( )
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
2 |
|
|
|
c |
|
d |
|
|
3 |
a |
b |
|
|
|
e |
f |
A. e的氢化物比d的氢化物稳定
B. a、b、e三种元素的原子半径:e>b>a
C. 六种元素中,c元素单质的化学性质最活泼
D. c、e、f的最高价氧化物对应的水化物的酸性依次增强
12. 1934年居里夫妇用α粒子(4He)轰击27Al得到一种自然界不存在的磷元素的一种同位素(3015P),开创了人造核素的先河:2713Al+42He  3015P+10n。下列有关说法不正确的是(
)
3015P+10n。下列有关说法不正确的是(
)
A. 该变化说明原子核在一般的化学反应中也能发生变化
B. 该变化同样遵循质量守恒定律
C. 10n是一种电中性粒子
D. 对于3015P有:原子序数=质子数=中子数=核外电子数
11. (2008年高考全国卷Ⅰ)下列各组给定原子序数的元素,不能形成原子数之比为1∶1稳定化合物的是( )
A. 3和17 B. 1和8
C. 1和6 D. 7和12
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com