
题目列表(包括答案和解析)
5.下列铵盐①NH4F ②NH4Cl ③NH4Br ④NH4I,其热稳定性由强到弱的顺序为( )
A.④>③>②>① B.①>②>③>④
C.①>④>③>② D.无法确定
解析:铵盐受热分解的过程就是铵根离子(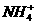 )把质子转移给酸根的过程,对于题目所给四种同类型的铵盐,酸根离子半径越小,结合H+能力越强,则盐就越不稳定,答案为A。
)把质子转移给酸根的过程,对于题目所给四种同类型的铵盐,酸根离子半径越小,结合H+能力越强,则盐就越不稳定,答案为A。
答案:A
4.在标准状况下,在三个干燥的烧瓶内分别装入有干燥纯净的NH3、含一半空气的氯化氢气体、NO2和O2的混合气体(V(NO2)∶V(O2)=4∶17)。然后分别做喷泉实验,三个烧瓶中所得溶液的物质的量浓度之比为( )
A.2∶1∶2 B.5∶5∶4
C.1∶1∶1 D.无法确定
解析:NH3、HCl溶于水后,溶液的体积即为被溶解了的气体体积,c=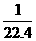 mol·L-1。由4NO2+O2+2H2O====4HNO3可知,当O2过量时,每消耗4 mol NO2、1 mol O2,则生成4 mol HNO3,c(HNO3)=
mol·L-1。由4NO2+O2+2H2O====4HNO3可知,当O2过量时,每消耗4 mol NO2、1 mol O2,则生成4 mol HNO3,c(HNO3)=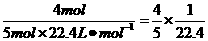 mol·L-1。故答案为B。
mol·L-1。故答案为B。
答案:B
3.用加热方法可分离的一组物质是( )
A.氯化铵和消石灰 B.碳铵和过氧化钠
C.碘和食盐 D.硝酸铵和硫酸钠
解析:氯化铵与消石灰发生反应产生NH3、H2O和CaCl2,显然无法分离。碳铵加热分解同时与过氧化钠发生反应。硝酸铵受热分解产物更复杂,故答案为C。
答案:C
2.(2010山东潍坊质检)在下列几种物质中:①NaHCO3、②Al(OH)3、③(NH4)2CO3、④SiO2、⑤金属铝、⑥Al2O3,其中与HCl溶液和NaOH溶液都能发生反应的是( )
A.只有②④⑥ B.只有①⑤⑥
C.只有①②③⑤⑥ D.全部都可以
解析:二氧化硅只能与氢氧化钠反应而不能与盐酸反应,因此只能选C。
答案:C
1.有关氨的说法不正确的是( )
A.NH3是4核10电子极性分子,三角锥形,具有还原性
B.NH3极易溶于水,可做喷泉实验,氨气易液化,液氨可用作制冷剂
C.氨气是非电解质,氨水是电解质
D.蘸有浓盐酸的玻璃棒遇氨气可产生白烟
解析:NH3分子中氮元素-3价是最低价态,因此NH3具有还原性,A正确;根据相似相溶原理知极性分子NH3易溶于极性溶剂H2O,氨的蒸发热很大,可作制冷剂,B正确;电解质、非电解质都指化合物,而氨水是混合物,故C不正确;浓盐酸与NH3作用产生白色晶体NH4Cl,故D正确。
答案:C
11.资料:管道煤气的主要成分是氢气、一氧化碳和甲烷,热值15.6 MJ·kg-1,每立方米是0.90元,液化气是C3-C4的烷烯烃,热值47.3 MJ·kg-1,每千克2.60元,水的比热容为4.18 kJ·(kg·℃)-1。
(1)将一壶水(以4 L计),从25 ℃加热至100 ℃,用液化气和管道煤气,哪一种更合算?(热量利用率以70%计)
(2)你认为用液化气好还是用管道煤气好?简述你的理由。
解析:由Q=mcΔt可得4 kg水从25 ℃至100 ℃需吸收热量Q=75 ℃×4.18 kJ·(kg· ℃)-1×4 kg=1254 kJ,若用液化气需吸收热量70%×m×47 MJ·kg-1×103=1254 kJ
m=0.04 kg,成本为0.04 kg×2.60元/kg=0.104元,若用管道煤气70%×V×15.6 MJ·m3×103=1254 kJ
V=0.114 m3,成本为0.114 m3×0.90元/m3=0.103元,因此用液化气和管道煤气差不多合算。
答案:(1)差不多合算(液化气:0.104元,管道煤气:0.103元)
(2)属开放型题目,只要叙述的理由合理均可以。
10.城市使用的燃料,现大多为煤气、液化石油气。煤气的主要成分是一氧化碳和氢气的混合气,它由煤炭与水(蒸气)反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学反应式:______________________________________。
(2)液化石油气主要成分是丙烷,丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)====3CO2(g)+
4H2O(l);ΔH=-2 220.0 kJ·mol-1
已知CO气体燃烧的热化学方程式为
CO(g)+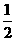 O2(g)====CO2(g);
O2(g)====CO2(g);
ΔH=-282.57 kJ·mol-1
试比较同物质的量的C3H8和CO燃烧,产生的热量比值约为_______。
(3)已知氢气燃烧的热化学方程式为2H2(g)+O2(g)====2H2O(l);ΔH=-571.6 kJ·mol-1
试比较同质量的氢气和丙烷燃烧,产生的热量比值约为___________。
(4)氢气是未来的能源,除产生的热量大之外,还具有的优点是___________________。
解析:本题结合当前城市使用的燃料,来考查学生对热化学反应方程式的热量计算,考点新颖,知识难度系数较小。学生若细心、认真领悟题意,应该能给出理想答案。
答案:(1)C+H2O(g) CO+H2
CO+H2
(2)39∶5(3)14∶5
(4)来源丰富,单位质量氢气产生热量大,无污染
9.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
(1)反应的热化学方程式为______________。
(2)又已知H2O(l)====H2O(g);ΔH=+44 kJ·mol-1,由16 g液态肼与液态双氧水反应生成液态水时放出的热量是_________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
____________________________________________________________。
解析:(1)①由反应时电子得失分析:N2H4N2 N2失去4e-;H2O2
N2失去4e-;H2O2 2H2O得到2e-。②书写热化学方程式时必须注明物质的聚集状态和反应总的热量变化情况。③N2H4的反应热为256.652 kJ×
2H2O得到2e-。②书写热化学方程式时必须注明物质的聚集状态和反应总的热量变化情况。③N2H4的反应热为256.652 kJ×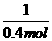 =641.63 kJ·mol-1。
=641.63 kJ·mol-1。
(2)16 g肼的物质的量为0.50 mol,与N2H4完全反应生成液态水时放出的总热量为:Q=641.63 kJ·mol-1×0.50 mol+4×0.50 mol×44 kJ·mol-1=408.815 kJ。
答案:(1)N2H4(l)+2H2O2(l)====N2(g)+4H2O(g);ΔH=-641.63 kJ·mol-1 (2)408.815 (3)产物不会造成环境污染
8.分析某种煤气的体积组成如下:H2 50%、CH4 30%、CO 10%、N2 6%、CO2 4%。
已知:H2(g)+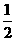 O2(g)====H2O(l);ΔH=-285.8
kJ·mol-1
O2(g)====H2O(l);ΔH=-285.8
kJ·mol-1
CO(g)+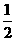 O2(g)====CO2(g);ΔH=-282.6
kJ·mol-1
O2(g)====CO2(g);ΔH=-282.6
kJ·mol-1
CH4(g)+2O2(g)====CO2 (g)+2H2O(l);
ΔH=-890.3 kJ·mol-1
则在标准状况下,224 L该种煤气燃烧时放出的热量为( )
A.1461.7 Kj B.4382.5 kJ
C.4665.1 kJ D.5811.5 kJ
解析:本题考查热化学方程式的计算。由题意知224 L该种煤气中含H2:(224 L×50%)÷22.4 L·mol-1=5 mol,完全燃烧放出热量为5 mol ×285.8 kJ·mol-1=1429 kJ;同理CO放热(224 L×10%)÷22.4 L·mol-1×282.6 kJ·mol-1=282.6 kJ;CH4放热(224 L×30%)÷22.4 L·mol-1×890.36 kJ·mol-1=2670.9 kJ;三者之和为4382.5 kJ,B正确。
答案:B
7.(2010江苏镇江高三模拟) 分析图1-2的能量变化示意图,确定下列选项中正确的是 ( )
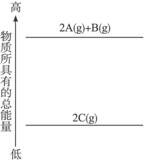
图1-2
A.2A(g)+B(g)====2C(g);ΔH<0 B.2A(g)+B(g)====2C(g);ΔH>0
C.2A+B====2C;ΔH<0 D.2C====2A+B;ΔH<0
解析:本题考查化学反应吸热、放热的原因及表示。若反应物所具有的总能量>生成物的总能量,该反应为放热反应,ΔH为“-”或“ΔH<0”;反之为吸热反应。由图知E(2 A+B)>E(C),该反应2 A(g)+B(g)====2C(g)为放热反应(ΔH<0),A正确、B错误。又因热化学方程式必须注明物质状态,故C、D错误。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com