
题目列表(包括答案和解析)
10.将m g Al2O3和Fe2O3的混合物溶于100 mL盐酸中,然后逐滴加入1 mol·L-1 NaOH溶液,其结果如图11-1所示。
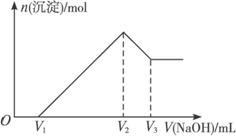
图11-1
(1)最初加入V1 mL NaOH溶液的作用是__________________________________________。
(2)盐酸的物质的量浓度是___________________________。
(3)若m g混合物中Al2O3与Fe2O3按不同比例进行上述实验(其他条件不变),则V2的值改变________(填“会”或“不会”),(V2-V1)的取值范围是_________________________。
解析:这是一道涉及铝图象计算题。从图中看出氢氧化钠溶液体积0-V1时,无沉淀,故中和的是过量的盐酸,V1-V2氢氧根离子与Al3+、Fe3+结合形成沉淀,当在V2时沉淀完全,此时溶液中只有氯化钠,即盐酸的物质的量与氢氧化钠的物质的量相等,可借此求得盐酸的浓度,又可确定V2的值只与盐酸的用量有关,而与Al2O3、Fe2O3相对量无关。问题(3)求V2-V1的取值范围,这一段是沉淀Al3+、Fe3+,每摩离子均只消耗3 mol氢氧化钠,可利用极限法:若只含Al2O3,则Al3+物质的量为m/51 mol;若只含Fe2O3,则Fe3+物质的量为m/80 mol,从而确定氢氧化钠的物质的量及取值范围。
答案:(1)中和过量的盐酸 (2)V2×10-2 mol·L-1 (3)不会 3m/80×103<(V2-V1)<m/17×103
9.根据下图推断填空:
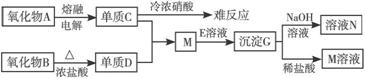
(1)C是______________,D是______________,G是______________。(填化学式)
(2)写出下列反应的离子方程式:
B+浓盐酸:________________________________________;
G+NaOH溶液:____________________________________。
(3)单质C不能跟冷浓HNO3反应的原因是________________________________________。
解析:由于单质C不与冷浓HNO3反应,可知C可能为Fe或Al,又由氧化物A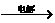 C,知C一定为Al。而M与E溶液作用得到沉淀G,G可与NaOH及稀盐酸反应,故G应为?Al(OH)3。由于单质D与Al作用生成化合物M,则D应为非金属单质,由氧化物B在加热条件下与浓盐酸反应生成D知氧化物B应为MnO2,故D为Cl2、M为AlCl3、N为NaAlO2。
C,知C一定为Al。而M与E溶液作用得到沉淀G,G可与NaOH及稀盐酸反应,故G应为?Al(OH)3。由于单质D与Al作用生成化合物M,则D应为非金属单质,由氧化物B在加热条件下与浓盐酸反应生成D知氧化物B应为MnO2,故D为Cl2、M为AlCl3、N为NaAlO2。
答案:(1)Al Cl2 Al(OH)3
(2)MnO2+2Cl-+4H+ Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
Al(OH)3+OH-====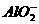 +2H2O (3)铝遇冷浓硝酸钝化
+2H2O (3)铝遇冷浓硝酸钝化
8.如图所示,A、B、F、M为常见的单质,其中F为黑色固体,其余为化合物,D是可以使湿润的红色石蕊试纸变蓝的气体。完成下列问题:
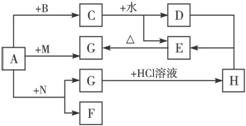
(1)写出下列物质的化学式,A_________________;C__________________;E_____________;H________________。
(2)写出A+N,C+H2O的化学方程式:?________________________________________。
(3)写出H的水溶液与D反应的离子方程式:?______________________________________。
(4)写出A单质与热水反应的化学方程式:?________________________________________。
解析:D是可使湿润的红色石蕊试纸变蓝色的气体,故D为NH3,这是本题的突破口。D由C与水反应生成,C为金属氮化物,常见为Mg3N2,则E为Mg(OH)2,G为MgO,A为Mg。
答案:(1)Mg Mg3N2 Mg(OH)2 MgCl2
(2)2Mg+CO2 2MgO+C,
2MgO+C,
Mg3N2+6H2O====2NH3↑+3Mg(OH)2↓
(3)Mg2++2NH3+2H2O====Mg(OH)2↓+2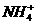
(4)Mg+2H2O Mg(OH)2↓+H2↑
Mg(OH)2↓+H2↑
7.某无色溶液中,已知含有H+、Al3+、Mg2+等阳离子,逐渐加入NaOH溶液,则消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系可用下图来表示,则下列关系正确的是( )
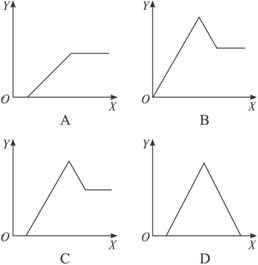
解析:无色溶液中加入氢氧化钠溶液时,OH-首先与H+反应,无沉淀生成,然后再与Mg2+、Al3+作用形成沉淀,沉淀处于最高点时Mg2+、Al3+全部以氢氧化物析出,继续加碱时,由于氢氧化铝具有两性会继续溶解,而氢氧化镁不能溶解,故A、B、D均不正确。
答案:C
6.把Ba(OH)2溶液滴入明矾溶液中,使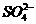 全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A.Al3+ B.Al(OH)3
C.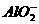 D.Al3+和Al(OH)3
D.Al3+和Al(OH)3
解析:明矾为KAl(SO4)2·12H2O,其溶液中Al3+与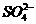 的物质的量之比为1∶2,若沉淀2 mol
的物质的量之比为1∶2,若沉淀2 mol 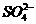 ,则需2 mol Ba(OH)2,提供4 mol OH-,4 mol OH-恰好把1 mol Al3+完全转变为
,则需2 mol Ba(OH)2,提供4 mol OH-,4 mol OH-恰好把1 mol Al3+完全转变为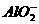 ,所以答案为C。
,所以答案为C。
答案:C
5.只用胶头滴管和试管,不用其他试剂就可以区别的溶液(浓度均为0.1 mol·L-1)是( )
A.CaCl2和Na2CO3 B.Ba(OH)2和NaHCO3
C.稀H2SO4和Na2CO3 D.NaAlO2和NaOH
解析:不用试剂区别两种溶液,除了用观察法以外,一般可用滴加顺序不同现象不同的方法(即互滴法)鉴别。稀H2SO4逐滴加到Na2CO3溶液中,开始因生成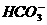 而无气体放出,但若反滴,则开始便可放出CO2;NaAlO2与NaOH不反应。
而无气体放出,但若反滴,则开始便可放出CO2;NaAlO2与NaOH不反应。
答案:C
4.将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )
A.3 mol·L-1 HCl B.4 mol·L-1 HNO3
C.8 mol·L-1 NaOH D.18 mol·L-1 H2SO4
解析:A.Mg、Al都与盐酸反应放出H2。?B.Mg、Al与HNO3反应无H2产生。C.Al与NaOH溶液反应放出H2,且和Al与HCl反应放出H2的量相等,Mg与NaOH溶液不反应。D.Mg在18 mol·L-1 H2SO4中反应放出SO2无H2产生,Al在18 mol·L-1 H2SO4中钝化。
答案:A
3.甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是( )
A.Al2(SO4)3 B.NaOH C.BaCl2 D.FeSO4
解析:丁溶液滴入乙溶液,有白色沉淀;继续滴入丁溶液白色沉淀消失,判断丁为NaOH、乙为Al2(SO4)3。将NaOH溶液滴入甲,无现象,则甲为BaCl2、丙为FeSO4。
答案:D
2.镁比铝元素的金属性强,以下说法不能说明这一点的是( )
A.氢氧化镁是中强碱而氢氧化铝具有两性
B.铝在冷的浓硫酸中钝化而镁不钝化
C.氯化镁的熔点比氯化铝的熔点高
D.镁能与沸水发生置换反应而铝不能
解析:金属性强弱的比较,可以比较金属最高价氧化物对应水化物碱性强弱,比较金属单质跟水或酸置换氢的能力;另外MgCl2熔点高于AlCl3,可比较镁、铝金属性强弱。因阴离子相同,Mg2+半径大于Al3+,若同为离子化合物,则应AlCl3熔点高,现MgCl2熔点高是因MgCl2为离子化合物,而AlCl3不属于离子化合物,说明金属性镁强于铝。
答案:B
1.把镁粉中混入的少量铝粉除去,应选用的试剂是( )
A.盐酸 B.氯水 C.烧碱溶液 D.纯碱溶液
解析:盐酸跟镁、铝都反应,A错。氯水中存在游离氯,是氧化剂,镁、铝都有还原性,是还原剂,都会和氯反应;氯水中有氯和水反应的生成物--盐酸和次氯酸,镁、铝都会跟酸反应,B错。烧碱是氢氧化钠,铝有两性,可以跟氢氧化钠溶液反应放出氢气,铝变成偏铝酸钠溶于水,镁不反应而分离,2Al+2NaOH+2H2O====2NaAlO2+3H2↑,C对。纯碱溶液,是碳酸钠溶液,镁、铝都不与之反应,D错。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com