
题目列表(包括答案和解析)
5.关于下列各装置图的叙述中,不正确的是
 A.装置①中,d为阴极、c为阳极
A.装置①中,d为阴极、c为阳极
B.装置②可用于收集H2、CO2、HCl、NO2等气体(必要时可添加尾气处理装置)
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并能防止倒吸
D.装置④中可用于干燥、收集氯化氢,并吸收多余的氯化氢
4. 己知反应:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol
②稀溶液,H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol
下列结论正确的是 ( )
A.碳的燃烧热大于110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
3.下列化学反应的离子方程式正确的是 ( A )
A. 向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO3-+2OH-== CaCO3↓+2H2O+CO32-
B. 1 mol/L的NaAlO2溶液和3 mol/L的HCl等体积互相均匀混合:
2AlO2-+5H+ = Al(OH)3↓+Al3++H2O
C.用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S
D.NH4HSO4溶液中加入足量Ba(OH)2溶液: H++SO +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
2. NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,1mol水含有NA个H+和NA个OH-离子
B.在通常状况下,22.4 LH2和4 gHe均含有NA个分子
C.8.0 g Cu2S和CuO的混合物中约含有铜原子数为0.1NA
D.常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数约为0.3NA
1.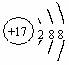 下列化学用语表达正确的是
( )
下列化学用语表达正确的是
( )
A.S2-的结构示意图: B.Cu的电子排布式:1S22S22P63S23P63d94S2
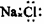 C.NaCl的电子式:
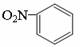
D.硝基苯的结构简式:
C.NaCl的电子式:
D.硝基苯的结构简式:
11.快乐是什么?精神病学专家通过实验发现:在大脑的相应部位-“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态。人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统。多巴胺结构如右图:
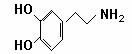 (1)多巴胺分子式:
。
(1)多巴胺分子式:
。
(2)试判断多巴胺能发生的化学反应
A.加成 B.取代 C.氧化 D.水解
(3)写出与多巴胺互为同分异构体且属于1、3、5三取代苯并且苯环上直接连有一个羟基和一个氨基且分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2︰1的所有物质的结构简式: 。 (4)多巴胺可由香兰素与硝基甲烷缩合,再经锌汞齐还原水解而得。合成过程表示如下:
|
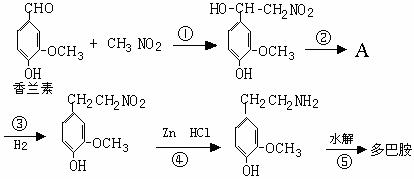
Ⅰ、写出下列反应类型:反应① ,反应② 。
Ⅱ、A的结构简式: 。
Ⅲ、写出②、⑤两步的化学方程式:
②:
⑤:
10.某研究性学习小组,用下列仪器、药品验证合金(由Cu、Fe、Zn三种物质组成)和适量浓硝酸反应产生的气体中含NO (N2和O2的用量可自由控制,气体液化温度:NO2 21℃ ;-NO -152℃)
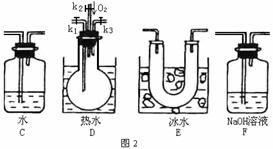
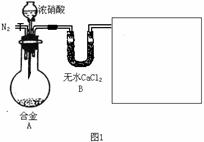
(1)在图2中选择恰当的仪器将图1补充完整,所选择仪器的连接顺序(按左→右连接,填各仪器编号)为
(2)反应前先通入N2目的是
(3)确认气体中含NO的现象是
(4)如果O2过量,则装置F中发生反应的化学方程式为:
(5)反应结束后,关闭K1、K2、K3,将D中的烧瓶从烧杯中拿出,观察到的现象
是 解释是
(6)本题中,浓硝酸(含溶质amol)完全反应,还原产物只有NO和NO2,被还原硝酸的物质的量n的取值范围为
9.已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略) ,请回答下列问题:
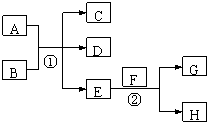
 (1)请写出F的电子式
;
(1)请写出F的电子式
;
在②反应中,当生成2.24L的G(标准状况)时,反应转移的电子数目为
(2)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出稀溶液中①的离子方程式: 。
(3)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B分别为 。(写化学式)
(4)若A与B均为固体化合物,C是常见的一种中性干燥剂,则反应①的化学方程式为 ;
若1.7g D与O2反应生成气态的产物时放出22.67kJ热量,写出该反应的热化学方程式: .
8、A、B、C、D四种物质均由短周期元素组成,其中A、B为酸式盐,B、C、D的焰色反应均呈黄色。相关实验及现象如下:
① 取A、B的溶液,分别加入足量的Ba(OH)2溶液,分别产生白色沉淀E、F,加热过滤E后的溶液,有刺激性气味的气体放出,该气体能使湿润的红色石蕊试纸变蓝;
② 向E、F中分别加入足量的稀硝酸,E溶解并产生无色无味的气体,F没有变化;
③ 向D的溶液中滴入少量B溶液,产生白色沉淀,该沉淀既能溶于过量的B溶液,也能溶于C的溶液。请回答:
(1) 写出化学式:B_____________, C_______________。
(2) D的溶液呈_____(填“酸”、“碱”或“中”)性,其原因是(用离子方程式表示)____________。
(3) D溶液中加入少量B溶液时反应的化学方程式为_________________________;
(4) A溶液中加入过量C溶液时反应的离子方程式为_________________________。
7.时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域。测定含I-浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度。主要步骤是
① 在中性溶液中,用溴将试样中I-氧化成IO3-,将过量的溴除去
② 再加入过量的碘化钾,在酸性条件下,使IO3-完全转化成I2
③ 将②中生成的碘完全萃取后,用肼将其还原成I-,方程式为H2N-NH2+2I2→4I-+N2↑+4H+
④ 将生成的I-萃取到水层后用①法处理。
⑤ 将④得到的溶液加入适量的KI溶液,并用硫酸酸化。
⑥ 将⑤反应后的溶液以淀粉作指示剂,用Na2S2O3标准溶液滴定,方程式为:
2 Na2S2O3+I2→Na2S4O6+2NaI
经过上述放大后,则溶液中I-浓度放大为原溶液中I-浓度的(设放大前后溶液体积相等)
A.2倍 B.4倍 C.6倍 D.36倍
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com