
题目列表(包括答案和解析)
9.用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象可得出两条有关过氧化钠跟水反应的结论是:
第一,有氧气生成;第二,_____________________。过氧化钠与水的反应中,还原剂是:_______________________。
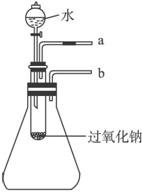
图2-1
(2)某研究性学习小组拟用如图21所示装置进行实验,以证明上述结论。
用以验证第一条结论的实验方法及现象是_____________________________________。
用以验证第二条结论的实验方法及现象是_____________________________________。
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入石蕊试液,发现溶液变蓝,振荡后,蓝色褪去。为探究此现象,该小组同学从查阅有关资料中得知过氧化钠跟水反应可生成过氧化氢,过氧化氢具有强氧化性和漂白性。请设计一个简单实验,证明过氧化钠和足量水充分反应后的溶液中有过氧化氢存在。现有硫化钠溶液、亚硫酸钠溶液、硫酸亚铁溶液、碘化钾溶液、红色布条等,请从中选择试剂,加以验证。(只要求列出实验所用的试剂及观察到的现象)
试剂:_________________________________________________________________________;
现象:_________________________________________________________________________。
解析:(1)当滴加几滴水时,脱脂棉会剧烈燃烧,说明过氧化钠与水的反应为放热反应。过氧化钠与水的反应,Na2O2既作氧化剂,又作还原剂。
(2)若有O2产生则可使带火星的木条复燃,故可用带火星的木条靠近试管口a验证第一条结论。由所给图示可知,若反应放热,锥形瓶内温度升高,气压增大,若将导管b插入水中则会有气泡产生。
(3)H2O2具有强氧化性,可氧化S2-、I-而使溶液变浑浊或使淀粉变蓝色。由于H2O2具有漂白性,可使有色布条褪色。根据所给试剂不难选出硫化钠溶液或有色布条可用来验证H2O2的氧化性。
答案:(1)该反应为放热反应 Na2O2
(2)将带火星的木条靠近管口a,木条复燃;将导管b插入水中,反应过程中导管口有气泡冒出
(3)硫化钠溶液 溶液变浑(或红色布条布条褪色)
8.下列各步反应,A为金属,B为淡黄色固体,且每种物质均含A元素。
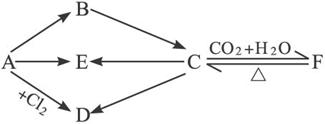
写出A、B、C、D、E、F的化学式及有关化学方程式。
解析:此题要先考虑B为何物质,金属对应的化合物是淡黄色,我们可暂定为Na2O2,那么A为Na,D为NaCl,通过CO2和H2O参加C与F的转化可知,C、F为碳酸盐即C为Na2CO3,F为NaHCO3,最后确定E为NaOH。
答案:Na Na2O2 Na2CO3 NaCl NaOH NaHCO3
A B:2Na+O2
B:2Na+O2 Na2O2
Na2O2
A D:2Na+Cl2
D:2Na+Cl2 2NaCl
2NaCl
A E:2Na+2H2O====2NaOH+H2↑
E:2Na+2H2O====2NaOH+H2↑
B C:2Na2O2+2CO2====2Na2CO3+O2
C:2Na2O2+2CO2====2Na2CO3+O2
C E:Na2CO3+Ca(OH)2====CaCO3↓+2NaOH
E:Na2CO3+Ca(OH)2====CaCO3↓+2NaOH
C D:Na2CO3+2HCl====2NaCl+H2O+CO2↑
D:Na2CO3+2HCl====2NaCl+H2O+CO2↑
C F:Na2CO3+CO2+H2O====2NaHCO3
F:Na2CO3+CO2+H2O====2NaHCO3
F C:2NaHCO3
C:2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
7.(2010安徽合肥高三模拟)使5.6 L CO2气体迅速通过Na2O2固体后得到4.48 L气体(标准状况下),这4.48 L气体的质量为( )
A.8.8 g B.6.4 g C.8.2 g D.6.2 g
解析:反应前后气体的物质的量分别为:
n (前)=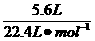 =0.25 mol
=0.25 mol
n (后)=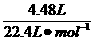 =0.20 mol,Δn=n(前)-n(后)=0.05 mol
=0.20 mol,Δn=n(前)-n(后)=0.05 mol
运用差量法:
2Na2O2+2CO2====2Na2CO3+O2 Δn
2 mol 1 mol 1 mol
0.05 mol 0.05 mol
得反应后的0.2 mol气体中含0.05 mol O2和0.15 mol CO2,故反应后的气体总质量=0.15 mol×44 g·mol-1+0.05 mol×32 g·mol-1=8.2 g。
答案:C
6.(2010湖北武汉高三模拟)过氧化钠与足量的碳酸氢钠混合后,在密闭容器中充分加热,排除气体后冷却,残留的固体物质是( )
A.NaOH、Na2CO3 B.Na2CO3
C.NaOH D.NaOH、Na2CO3、Na2O2
解析:发生的反应有:2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
2Na2O2+2CO2====2Na2CO3+O2
2Na2O2+2H2O====4NaOH+O2↑
2NaOH+CO2====Na2CO3+H2O
由题给信息过氧化钠与足量的碳酸氢钠混合,知CO2过量,不可能存在NaOH,因此排除气体物质后冷却,残留固体物质只能是Na2CO3,故选B。
答案:B
5.有关纯碱和小苏打的叙述正确的是( )
A.等质量的Na2CO3、NaHCO3分别与足量稀H2SO4反应,NaHCO3产生的CO2多
B.等质量的Na2CO3、NaHCO3分别与足量的同种盐酸反应,NaHCO3消耗的盐酸多
C.向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀
D.Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠反应
解析:Na2CO3、NaHCO3分别与HCl反应,有关物质的质量关系是:
Na2CO3+2HCl====2NaCl+H2O+CO2↑
106 g 73 g 44 g
NaHCO3+HCl====NaCl+H2O+CO2↑
84 g 36.5 g 44 g
显然,等质量的Na2CO3、NaHCO3分别与盐酸反应,NaHCO3产生二氧化碳多,Na2CO3消耗盐酸多,故A正确,B不正确。向NaHCO3溶液中滴加Ba(OH)2有如下反应: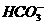 +OH-====
+OH-====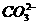 +H2O
+H2O 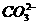 +Ba2+====BaCO3↓,C选项不正确。Na2CO3溶液不能与NaOH反应,D选项不正确。
+Ba2+====BaCO3↓,C选项不正确。Na2CO3溶液不能与NaOH反应,D选项不正确。
答案:A
4.(2010天津河西检测)下列各组性质的比较中,不正确的是( )
A.热稳定性 Na2CO3>NaHCO3>H2CO3
B.熔点 二氧化硅>食盐>金属钠>干冰
C.酸性 H3PO4<H2SO4<HClO4
D.沸点 H2Se>H2S>H2O
解析:热稳定性:碳酸正盐>碳酸氢盐>碳酸。
B项注意:金属的熔点变化较大,应联系具体物质进行对比。
C项归纳:非金属性越强,其最高价含氧酸的酸性越强。
D项要求:强调在H2O中存在氢键使其沸点反常升高。
答案:D
3.对过氧化钠的叙述正确的是( )
A.在反应中只可作氧化剂 B.在反应中既可作氧化剂又可作还原剂
C.是典型的碱性氧化物 D.可用于防毒面具上
解析:Na2O2在反应中氧元素从-1价变为-2价和0价,所以既是氧化剂又是还原剂;Na2O2与酸反应生成盐和水的同时,还有O2生成,不符合碱性氧化物的定义;Na2O2是用于呼吸面具上,不是用于防毒面具上,防毒面具是用活性炭。
答案:B
2.一块表面已被氧化成氧化钠的钠块5.4 g投入足量的水中,最多能产生0.1 g气体。则原来被氧化的钠的质量是( )
A.2.3 g B.3.1 g C.4.6 g D.5.3 g
解析:不少学生对此题题意理解不深,将所问原来被氧化的钠的质量,理解成被氧化为氧化钠的质量。由H2质量求得已被氧化成氧化钠的质量,再由氧化钠Na2O-2Na,求出原来钠的质量。
答案:A
1.将钠投入下列溶液中,反应的剧烈程度由强到弱的是( )
①水 ②NaOH溶液 ③0.1 mol·L-1盐酸 ④0.1 mol·L-1硫酸铁溶液
A.④③②① B.④③①② C.③④①② D.①③④②
解析:本题通过Na与水反应的实质--Na与H+间的氧化还原反应,考查了影响化学反应速率因素。c(H+)越大,反应速率越快,其中显酸性的是③④,但④是因Fe3+水解显弱酸性,故其排列顺序为:cH+(HCl)>cH+(Fe2(SO4)3)>10-7 mol·L-1,而②是碱溶液,c (H+)<10-7 mol·L-1,①中水呈中性,c(H+)=10-7 mol·L-1,所以c(H+)的大小顺序为:③>④>①>②,即为反应的剧烈程度由强到弱的顺序。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com