
题目列表(包括答案和解析)
10.对于反应2NO2(g) N2O4(g),在一定条件下达到平衡,在温度不变时,欲使的比值增大,应采取的措施是( )
N2O4(g),在一定条件下达到平衡,在温度不变时,欲使的比值增大,应采取的措施是( )
①体积不变,增加NO2的物质的量 ②体积不变,增加N2O4的物质的量 ③使体积增大到原来的2倍
④充入N2,保持压强不变
A.①② B.②③
C.①④ D.③④
解析:体积不变,增加NO2,相当于增大压强,平衡右移,比值变小,①错;②与①类似;体积增大,相当于减压,平衡左移,比值变大;充入N2,保持压强不变,体积增大,相当于减压,比值变大。
答案:D
9.一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO): ,甲醇生成量与时间的关系如下图所示。下列有关说法正确的是( )
,甲醇生成量与时间的关系如下图所示。下列有关说法正确的是( )
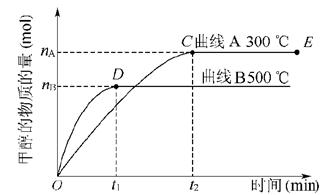
A.在300 ℃条件下,t1时刻该反应达到化学平衡
B.在500 ℃条件下,从反应开始到平衡,氢气的平均反应速率v(H2)为nB/(3t1) mol/L
C.在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,则氢气的浓度减小
D.由图像说明该反应的正反应为放热反应
解析:在300 ℃条件下,t2时刻反应达到平衡;在500 ℃条件下,t1时刻反应达到平衡,此时甲醇的物质的量为nB,反应消耗氢气的物质的量为2nB,氢气的平均反应速率为2nB/3t1 mol/(L·min);体积缩小,反应物和生成物浓度均增大,虽压强增大,平衡右移,但根据勒夏特列原理可知,它只能减弱这种改变而不能抵消这种改变,C错;从图像可知温度高时平衡体系中甲醇含量减少,可以推出 的正反应为放热反应。
的正反应为放热反应。
答案:D
8.在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A.①③⑤ B.②③⑤
C.②⑤ D.①③④
解析:增大反应物的浓度和增大压强,只能增大活化分子数,不能增大活化分子百分数,而②和⑤既能增大活化分子数,又能增大活化分子百分数。
答案:C
7.2007年2月,中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2和CO2。下列对此反应的叙述中正确的是( )
A.使用光催化剂不改变反应速率
B.使用光催化剂能增大NO的转化率
C.升高温度能加快反应速率
D.改变压强对反应速率无影响
答案:C
6.可逆反应:3A(g) 3B(?)+C(?)(ΔH>0),随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
3B(?)+C(?)(ΔH>0),随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
A.B和C可能都是固体
B.B和C一定都是气体
C.若C为固体,则B一定是气体
D.B和C可能都是气体
解析:该正反应吸热,温度升高,平衡右移,变小,则B、C肯定不会都是固体;若都是气体,符合题意;但若B为气体,C为固体也符合题意。
答案:CD
5.在体积可变的密闭容器中,反应mA(g)+nB(s) pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低,下列说法中,正确的是( )
pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低,下列说法中,正确的是( )
A.(m+n)必定小于p B.(m+n)必定大于p
C.m必定小于p D.m必定大于p
解析:压缩容器的体积,A的转化率降低,说明该正反应体积增大,B是固体,故m<p,而(m+n)可能小于、等于或大于p,只有C选项符合题意。
答案:C
4.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是( )
A.平衡向正反应方向移动了
B.物质A的转化率增大了
C.物质B的质量分数增加了
D.a>b
解析:此题应用分段假设法分析,先假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,现在不是50%而是60%,比假设大,说明平衡向生成B的方向移动,则a<b,由于平衡向正反应方向移动,A减少,B增多,则B的质量分数必然增加。
答案:D
3.在一定条件下,固定体积的密闭容器中存在反应:2NO2(g) O2(g)+2NO(g) ΔH>0,达到平衡时,当改变其中的一个条件X,Y随X的变化符合图中曲线的是( )
O2(g)+2NO(g) ΔH>0,达到平衡时,当改变其中的一个条件X,Y随X的变化符合图中曲线的是( )

A.当X表示温度时,Y表示NO2的物质的量
B.当X表示压强时,Y表示NO2的转化率
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量
解析:选项C是对题目所给的物质的状态都为气态,反应容器为定容容器未注意,而认为随着反应的进行气体密度在变化;选项D应是直线性关系。正确的解题思路是:正反应是吸热反应,温度升高时,平衡向正向移动;增大压强使平衡将向逆向移动,NO2的转化率减小。
答案:AB
2.NO2中存在下列平衡:2NO2 N2O4(g)(正反应是放热反应)。在测定NO2的相对分子质量时,下列条件中较为适宜的是( )
N2O4(g)(正反应是放热反应)。在测定NO2的相对分子质量时,下列条件中较为适宜的是( )
A.温度130 ℃,压强3.03×105 Pa
B.温度25 ℃,压强1.01×105 Pa
C.温度130 ℃,压强5.05×104 Pa
D.温度0 ℃,压强5.05×104 Pa
解析:在测定NO2的相对分子质量时,应该尽量减少N2O4的含量,也就是应该尽量减少N2O4的含量,也就是应该尽量使上述反应平衡向左移动,即应尽量采取高温、低压的条件。
答案:C
1.能用能量判据判断下列过程的方向的是( )
A.水总是自发地由高处往低处流
B.放热反应容易自发进行,吸热反应不能自发进行
C.有序排列的火柴散落时成为无序排列
D.多次洗牌以后,扑克牌的毫无规律的混乱排列的概率大
解析:A.水总是自发地由高处往低处流,有趋向于最低能量状态的倾向。B.吸热反应也可以自发进行,例如,在25 ℃和1.01×105 Pa时,2N2O5(g)===4NO2(g)+O2(g) ΔH=+56.7 kJ/mol,(NH4)2CO3(s)===NH4HCO3(s)+NH3(g) ΔH=+74.9 kJ/mol。不难看出,上述两个反应都是吸热反应,又都是熵增的反应,显然只根据焓变来判断反应进行的方向是不全面的。C.有序排列的火柴散落时成为无序排列,有趋向于最大混乱度的倾向,属于熵判据。D.扑克牌的无序排列也属于熵判据。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com