
题目列表(包括答案和解析)
2.下列有关铁元素的叙述中正确的是 ( )
A.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3
B.氢氧化铁可以由相应的物质通过化合反应而制得
C.氢氧化铁与氢碘酸反应:
Fe(OH)3+3HI===FeI3+3H2O
D.铁元素位于周期表中第4周期ⅦA族
解析:A项:Fe与I2生成FeI2;B项:4Fe(OH)2+O2+2H2O===4Fe(OH)3;C项:Fe3+与I-不共存,Fe3+会氧化I-生成I2和Fe2+。
答案:B
1.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于 ( )
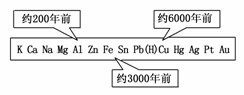
A.金属的导电性强弱
B.金属在地壳中的含量多少
C.金属的化合价高低
D.金属的活动性大小
解析:一般来说,越活泼的金属就越难冶炼,被人类开发利用的年限就越短。如Cu可以用C、CO等多种物质还原铜矿石冶炼得到,而Al需要用电解法才能冶炼得到,要困难得多。
答案:D
23.(12分)(2007·北京理综,28)北京市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以Ⅰ计) |
20-50 mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
________KIO3+________KI+________H2SO4===________K2SO4+________I2+________H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是______________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是______________________________。
(3)已知:I2+2S2O===2I-+S4O。
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2SO3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是________。
②b中反应所产生的I2的物质的量是________ mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)__________________________mg/kg。
解析:本题主要考查测定食盐中碘的含量的实验题。用化合价升降法来配平化学方程式。
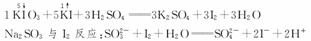
因为NaI、Na2SO4易溶于水,CCl4不溶于水,用分液法分开,上述操作步骤遗漏的操作是在b步骤之后增加将分液漏斗充分振荡后静置。因为I2+2S2O===2I-+S4O恰好完全反应,I2刚消耗完,溶液蓝色恰好变成无色。
I2+2S2O===2I-+S4O
n(I2)=2.0×10-3 mol·L-1××=1.0×10-5 mol
5KI+KIO3+3H2SO4===3K2SO4+3I2+3H2O
n(KIO3)=×1.0×10-5 mol
精制食盐中碘含量
= mg/kg
答案:(1)1 5 3 3 3 3
(2)①I2+SO+H2O===2I-+SO+2H+
②在步骤b后,增加操作:将分液漏斗充分振荡后静置
(3)①溶液由蓝色恰好变为无色
②1.0×10-5
③
22.(10分)A、B、C、D、E均为可溶于水的固体,组成它们的离子有
|
阳离子 |
Na+ |
Mg2+ |
Al3+ |
Ba2+ |
|
|
阴离子 |
OH- |
Cl- |
CO |
SO |
HSO |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
据此推断它们是
A________、B________、C________、D________、E________。
解析:本题主要考查离子反应,离子大量共存等问题;由实验④可知B中应含有Al3+,D中应含有OH-,但因反应过程中沉淀不消失,故在加碱溶解Al(OH)3的同时还应有沉淀生成,则不难确定D为Ba(OH)2,B为Al2(SO4)3,又根据离子大量共存规律,可知A、C、E中必有一种为Na2CO3,由实验①②③可推知A为Na2CO3,E为硫酸的酸式盐(NaHSO4、Mg(HSO4)2),C为可溶性镁盐(MgCl2或MgSO4)等,考虑A、B、C、D、E的组成离子可确定C为MgCl2。
答案:Na2CO3 Al2(SO4)3 MgCl2 Ba(OH)2 NaHSO4 (Mg(HSO4)2)
21.(11分)(2008·常州高中月考)对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(1)现有下列五种物质:SO2、SiO2、CaO、MgO、Fe2O3、Na2O2。按照不同的分类标准,它们中有一种物质与其他四种有明显的不同,请找出这种物质,并写出分类的依据。(至少要写出两种分类方法)
①________________________________________________________________________;
②________________________________________________________________________。
(2)从反应中有无离子参加,可以将化学反应分为离子反应和非离子反应,Na2O2与水反应的离子方程式是______________________________。从反应中___________________可以将化学反应分为氧化还原反应和非氧化还原反应,从上述氧化物中分别找出两种能相互反应的物质,各写一个非氧化还原反应的方程式和氧化还原反应的方程式: _______________、________________________。
(3)虽然分类的方法不同,但离子反应和氧化还原反应之间也存在着一定的关系,请用简单的图示方法表示两者之间的关系: __________________________________________。
________________________________________________________________________。
用离子反应方程式证明你的观点:______________________; ____________________。
解析:分类的关键是要找准分类的标准,分类的标准不同,得到的类别也不同。对于题中的五种物质,可以根据通常状况下物质状态的不同分类,也可以根据物质的化学性质分类。SO2和SiO2是酸性氧化物,CaO、MgO和Fe2O3是碱性氧化物,酸性氧化物和碱性氧化物在一定条件下可发生反应生成盐;Na2O2具有强氧化性,能将有还原性的SO2氧化。氧化还原反应和离子反应的是根据不同分类标准得到的反应类型,离子反应有的是氧化还原反应,有的是非氧化还原反应。
答案:(1)①SO2,常温常压下是气体,其余为固体 ②Na2O2,是过氧化物,氧元素呈-1价,其余物质中的氧元素呈-2价
(2)2Na2O2+2H2O===4Na++4OH-+O2↑ 有无电子转移
CaO+SiO2CaSiO3(其他合理答案也可)
Na2O2+SO2===Na2SO4
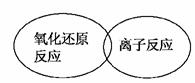
(3)(意思正确、能表示两者的交叉关系即可)
H++OH-===H2O 2H++Fe===Fe2++H2↑(或其他合理答案也可)
20.(8分)(2008·天津三模5月)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是________。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平)__________________________________。
(3)上述反应中,氧化剂是________,1 mol氧化剂在反应中________(填“得到”或“失去”)________ mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:__________________________________。
解析:(1)反应原理为在酸性条件下,KMnO4将Cl-氧化为Cl2,自身被还原成MnSO4。
(2)由(1)可知反应物为KMnO4、KCl、H2SO4,其余4种物质为生成物,根据得失电子守恒配平即可。
(4)中溶液又显紫红色,说明NaBiO3将Mn2+氧化成了MnO。
答案:(1)KCl H2SO4
(2)2KMnO4+10KCl+8H2SO4===6K2SO4+2MnSO4+5Cl2↑+8H2O
(3)KMnO4 得到 5
(4)NaBiO3具有强氧化性(比KMnO4氧化性强)
19.(5分)六水合三氯化铁与水反应生成的氢氧化铁胶体具有净水作用,被称为“净水剂”。明矾也是具有实用价值的净水剂之一。城市自来水厂常用这样的净水剂在常温下对大量的水进行净化
(1)写出KAl(SO4)2·12H2O净化原理:______________________________。(用离子方程式表示)
(2)取黄河水50 mL盛于烧杯中,再加入适量的明矾粉进行搅拌。在此过程中的现象是________。
(3)对食盐水和明矾水溶液进行鉴别的方法很多,若不用任何化学试剂进行鉴别,写出有关的方法和结论。
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
答案:(1)Al3++3H2OAl(OH)3(胶体)+3H+
(2)黄河水由浑浊变澄清,底部出现聚沉
(3)将一束光分别通过两种溶液,若可以看到一条光亮的“通路”,则为明矾水溶液。无此现象则为食盐水。
18.(2009·江西省南昌一中高三第二次月考)将含有O2和CH4的混合气体置于盛有23.4 g Na2O2的密闭容器中,电火花点燃,反应结束后,容器内的压强为零(150℃),将残留物溶于水中,无气体产生。下列叙述正确的是 ( )
A.原混合气体中O2和CH4的体积比为2:1
B.残留物只有Na2CO3
C.原混合气体中O2与CH4的物质的量之比为1:4
D.残留物只有Na2CO3和NaOH
答案:D
第Ⅱ卷(非选择题,共46分)
17.(2009·山东省东营市胜利一中高三第一学期期中考试)将纯铁丝5.21克溶于过量的稀硫酸中,在加热下用2.53克KNO3去氧化溶液中的Fe2+,待反应完全后,剩余的Fe2+尚需12.0毫升0.3摩/升的KMnO4溶液才能刚好完全氧化(已知KMnO的还原产物是Mn2+),请确定NO的还原产物: ( ) A.N2O B.NO
C.NO2 D.NH3
答案:C
16.(2009·山东省营南一中高三第一学期期末水平测试)阿波罗宇宙飞船以N2H4(联氨)和N2O4为推力源,反应温度达2700℃,反应式为2N2H4+N2O4=3N2+4H2O。关于该反应的说法中正确的是 ( )
A.属于置换反应
B.联氨是氧化剂
C.联氨是还原剂
D.氮气是氧化产物,不是还原产物
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com