
题目列表(包括答案和解析)
10.现有电解质溶液:
①Na2CO3、②NaHCO3、③NaAlO2、④CH3COONa、⑤NaOH,且已知:CO2+3H2O+2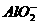
====2Al(OH)3↓+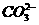 。
。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是______________(填编号)。
(2)将上述物质的量浓度均为0.1 mol·L-1的五种溶液,稀释相同倍数时,pH变化最大的是______________(填编号)。
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是______________(填编号)。
(4)将上述①②③④四种电解质溶液混合,发生反应的离子方程式为___________________。
解析:根据所给方程式可知Al(OH)3酸性比H2CO3弱。由于盐溶液的碱性强弱取决于阴离子的水解能力,故当pH相同时,越难水解的盐,浓度越大。
答案:(1)④>②>①>③>⑤
(2)⑤
(3)③④⑤
(4)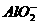 +
+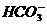 +H2O====Al(OH)3↓+
+H2O====Al(OH)3↓+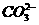
9.pH=2的某酸HnA与pH=12的某碱B(OH)m等体积混合后溶液的pH=8。
(1)写出正盐的化学式:______________________________。
(2)若该盐中只有一种离子水解,该离子水解的离子方程式为_________________________。
(3)简述该混合液呈碱性的原因。
解析:因为酸的pH与碱的pH之和等于14,等体积混合后pH=8>7,说明碱为弱碱,Bm+水解的离子方程式是:Bm++mH2O B(OH)m+mH+。HnA与B(OH)m等体积混合后,已电离的H+与OH-完全中和,弱碱继续电离产生OH-,显碱性。
B(OH)m+mH+。HnA与B(OH)m等体积混合后,已电离的H+与OH-完全中和,弱碱继续电离产生OH-,显碱性。
答案:(1)BnAm
(2)Bm++mH2O B(OH)m+mH+
B(OH)m+mH+
(3)等体积混合时,酸中的n(H+)与碱中的n(OH-)(溶液中)完全中和,pH=8说明碱为弱碱,H++OH-====H2O后,继续电离。
8.BiCl3水解产物中有BiOCl生成。
(1)写出水解反应方程式______________________。
(2)医药上将BiOCl称为次氯酸铋,该名称____________(填“正确”“不正确”)。
(3)如何配制BiCl3溶液?
解析:因为BiCl3+H2O BiOCl+2HCl,所以在配制BiCl3溶液时要防止其水解,方法是将BiCl3溶解在少量浓盐酸中,然后加水稀释即可。因为在BiOCl中氯元素的化合价为-1,而在HClO中氯元素的化合价为-1,故将BiOCl称为次氯酸铋不正确。
BiOCl+2HCl,所以在配制BiCl3溶液时要防止其水解,方法是将BiCl3溶解在少量浓盐酸中,然后加水稀释即可。因为在BiOCl中氯元素的化合价为-1,而在HClO中氯元素的化合价为-1,故将BiOCl称为次氯酸铋不正确。
答案:(1)BiCl3+H2O====BiOCl+2HCl
(2)不正确
(3)将适量的BiCl3固体溶于少量浓盐酸,再加水稀释。
7.明矾可作净水剂是因为____________________________________________________,有关的离子反应式为______________________________。工业上常用明矾和纯碱作膨化剂,因为两者发生反应,并在受热时生成________气体,有关的离子方程式为_____________________。
答案:明矾溶于水后,Al3+水解生成的胶体Al(OH)3吸附水中的悬浮物沉降到水底可起净水作用 Al3++3H2O 3Al(OH)3+3H+ 无色无味 2Al3++3
3Al(OH)3+3H+ 无色无味 2Al3++3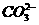 +3H2O====2Al(OH)3↓+3CO2↑
+3H2O====2Al(OH)3↓+3CO2↑
6.一种一元强酸HA溶液中加入一元碱MOH反应后,溶液呈中性,下列判断正确的是( )
A.加入的碱过量 B.生成的盐水解
C.酸碱等物质的量混合 D.反应后溶液中c(A-)=c(M+)
解析:电荷守恒:c(H+)+c(M+)=c(A-)+c(OH-),c(H+)=c(OH-),所以c(A-)=c(M+)。混合后溶液呈中性,若为强碱,则强酸强碱为1∶1混合,生成的盐MA不水解;若为弱碱,则强酸弱碱小于1∶1混合,生成的盐水解。
答案:D
5.将20 mL 0.4 mol·L-1硝酸铵溶液跟50 mL 0.1 mol·L-1氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )
A.c( )>c(OH-)>c(
)>c(OH-)>c( )>c(Ba2+)
)>c(Ba2+)
B.c( )>c(Ba2+)>c(OH-)>c(
)>c(Ba2+)>c(OH-)>c( )
)
C.c(Ba2+)>c( )>c(OH-)>c(
)>c(OH-)>c( )
)
D.c( )>c(Ba2+)>c(
)>c(Ba2+)>c( )>c(OH-)
)>c(OH-)
解析: +OH-
+OH- NH3·H2O,离子在反应过程中,Ba2+与
NH3·H2O,离子在反应过程中,Ba2+与 未参加反应,Ba2+仍为5×10-3 mol,
未参加反应,Ba2+仍为5×10-3 mol, 为8×10-3 mol。根据反应计算,OH-过量了2×10-3 mol,溶液显碱性。因为溶液较稀,且反应在常温时进行(无加热条件),氨气不会全部逸出,故溶液中仍有氨水电离出的
为8×10-3 mol。根据反应计算,OH-过量了2×10-3 mol,溶液显碱性。因为溶液较稀,且反应在常温时进行(无加热条件),氨气不会全部逸出,故溶液中仍有氨水电离出的 ,
, 比OH-要少得多,所以c(OH-)>c(
比OH-要少得多,所以c(OH-)>c( )。
)。
答案:B
4.草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1 mol·L-1 KHC2O4溶液中,下列关系正确的是( )
A.c(K+)+c(H+)=c( )+c(OH-)+c(
)+c(OH-)+c(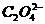 )
)
B.c( )+c(
)+c(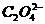 )=0.1 mol·L-1
)=0.1 mol·L-1
C.c(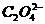 )<c(H2C2O4)
)<c(H2C2O4)
D.c(K+)=c(H2C2O4)+c( )+c(
)+c(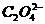 )
)
解析:根据电荷守恒,可知c(K+)+c(H+)=c( )+c(OH-)+c(
)+c(OH-)+c(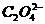 )×2,根据碳元素守恒,可知c(
)×2,根据碳元素守恒,可知c( )+c(
)+c(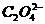 )+c(H2C2O4)=0.1
mol·L-1,而c(K+)=0.1 mol·L-1,故A、B不正确,D正确。由于草酸氢钾溶液呈酸性,则
)+c(H2C2O4)=0.1
mol·L-1,而c(K+)=0.1 mol·L-1,故A、B不正确,D正确。由于草酸氢钾溶液呈酸性,则 的电离程度大于水解程度,故c(
的电离程度大于水解程度,故c(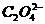 )>c(H2C2O4),C不正确。
)>c(H2C2O4),C不正确。
答案:D
3.(2010广东高考,8)下列在一定条件下进行的反应属于水解反应的是( )
①C12H22O11(麦芽糖)+H2O 2C6H12O6
2C6H12O6
②CH2==CH2+H2O CH3CH2OH
CH3CH2OH
③CH3CH2Cl+H2O CH3CH2OH+HCl
CH3CH2OH+HCl
④NH3·H2O
 +OH-
+OH-
⑤CH3CH2ONa+H2O CH3CH2OH+NaOH
CH3CH2OH+NaOH
⑥CaC2+2H2O Ca(OH)2+C2H2↑
Ca(OH)2+C2H2↑
A.②④ B.①②⑤ C.③④⑥ D.①③⑤⑥
解析:本题主要考查考生对水解反应反应实质的理解程度,根据对中学阶段所学盐类水解、卤代烃、糖类、蛋白质水解的归纳分析不难知道,水解反应的实质是,水电离产生的H+和OH-分别与其他物质结合而生成新的物质,显然本题中①③⑤⑥符合题意,而②属加成反应,④为氨水的电离,本题答案为D。
答案:D
2.物质的量相同的下列溶液中,含粒子种类最多的是( )
A.CaCl2 B.CH3COONa C.NH3 D.K2S
解析:对于CaCl2,几乎不发生水解,溶液中存在的粒子有Ca2+、Cl-、H+、OH-、H2O等5种。对于CH3COONa,由于发生水解:CH3COO-+H2O CH3COOH+OH-,溶液中存在Na+、CH3COOH、CH3COO-、H2O、H+、OH-等6种粒子。对于NH3,在溶液中存在的平衡为:NH3+H2O
CH3COOH+OH-,溶液中存在Na+、CH3COOH、CH3COO-、H2O、H+、OH-等6种粒子。对于NH3,在溶液中存在的平衡为:NH3+H2O NH3·H2O
NH3·H2O
 +OH-,溶液中存在着
+OH-,溶液中存在着 、NH3·H2O、NH3、H2O、H+、OH-等6种粒子。对于K2S,由于发生二级水解:S2-+H2O
、NH3·H2O、NH3、H2O、H+、OH-等6种粒子。对于K2S,由于发生二级水解:S2-+H2O HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O H2S+OH-,溶液中存在着K+、S2-、HS-、H2S、H2O、H+、OH-等7种粒子。
H2S+OH-,溶液中存在着K+、S2-、HS-、H2S、H2O、H+、OH-等7种粒子。
答案:D
1.在相同物质的量浓度的下列盐溶液中,c( )最大的是( )
)最大的是( )
A.NH4HSO4 B.NH4HCO3 C.CH3COONH4 D.NH4Cl
解析:四种盐溶液中 发生水解:
发生水解: +H2O
+H2O NH3·H2O+H+,在NH4HSO4溶液中,
NH3·H2O+H+,在NH4HSO4溶液中, ====H++
====H++ ,电离出的H+抑制了
,电离出的H+抑制了 的水解;而在NH4HCO3和CH3COONH4溶液中,
的水解;而在NH4HCO3和CH3COONH4溶液中,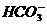 和CH3COO-也会发生水解,它们与
和CH3COO-也会发生水解,它们与 的水解是互相促进的,这样使c(
的水解是互相促进的,这样使c( )减小。NH4Cl水溶液中
)减小。NH4Cl水溶液中 的水解既没有促进也没有抑制。显然,NH4HSO4溶液中c(
的水解既没有促进也没有抑制。显然,NH4HSO4溶液中c( )最大。
)最大。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com