
题目列表(包括答案和解析)
8.(14分)元素化合物的知识是中学化学的重要知识,请结合有关知识回答下列问题:K^S*5U.C#O
(1)NaHCO3是发酵粉的主要成分之一,主要是利用其受热易分解的性质,请写出该反应的化学方程式:__________________________
(2)实验室储存的硝酸溶液经常显黄色,是因为溶解了__________(填物质的化学式)的缘故
(3)工业上制粗硅的方法是将硅石(SiO2)与碳在高温的条件下反应,该反应氧化剂与还原剂的物质的量之比为:______________
(4)工业上利用电解熔融的MgCl2制备金属镁,试写出其阴极反应式:_________________
(5)实验室制氯气的离子方程式为:_________________________________________
(6)高铁电池是一种新型可充电电池,其未配平的电池反应式为:
Zn+K2FeO4+H2O――Zn(OH)2+Fe(OH)3+KOH,则配平后KOH的化学计量数为
7.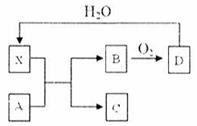 已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如下图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是:
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如下图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是:
A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水,一定可以观察到白色沉淀产生
D.工业上,B转化为D的反应条件为高温、常压、使用催化剂
5.已知298K时,氨水的电离平衡常数为1.76×10-5。现向20.00mL0.1mol/L氨水中逐滴加入等物质的量浓度的盐酸,下列示意图变化趋势正确的是

6.下列过程都与热量变化有关,其中表述不正确的是
A.CO(g)的燃烧热是283.0KJ/mol,则表示CO(g)燃烧反应的热化学方程式为:
CO(g)+1/2 O2(g)= CO2(g);△H=-283.0kJ/mol
B.水解反应是吸热反应,升温,水解平衡常数不变。
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
4.A、B、C、D、E、F为原子序数依次增大的短周期元素,其中A与E同主族,B与F同主族,E与F同周期,已知常温下A、E单质的聚焦状态不同,D原子的核电荷数是B原子最外层电子数的2倍,F单质是一种重要的半导体材料。下列说法正确的是
A.由A、C、D三种元素组成的化合物中可能含有离子键
B.F与D形成的化合物质地坚硬,既不与酸反应也不与碱反应
C.F、C、B元素最高价氧化物对应的水化物的酸性依次增强
D.原子半径由大到小的顺序是:C>D>E>F
3.下列事实与结论相符且正确的是
A.0.1mol·L-1 AlCl3溶液中含有Al3+数目一定小于0. 1NA(NA代表阿伏加德罗常数)
B.0.1 mol·L-1 Na2CO3溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C.相同温度下,pH相等的H2SO4和盐酸稀释相同倍数之后溶液的pH一定相等
D.Ksp(BaSO4)=1.07×10-10,Ksp(BaCO3)=2.58×10-9,所以任何条件都不能将BaSO4转化为BaCO3
2.已知:含碳碳双键的物质(如烯烃)一定条件下能与水发生加成反应,生成醇(含羟基的烃的衍生物);有机物A-D间存在图示的转化关系。下列说法正确的是
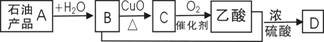
A.D结构简式为CH3C-O-OCH2CH3
B.A能使酸性高锰酸钾溶液褪色,不能使溴水因反应而褪色
|
 D.C转化为乙酸的化学方程式为:CH3CHO+O2
CH3COOH
D.C转化为乙酸的化学方程式为:CH3CHO+O2
CH3COOH
1.化学与生活、社会密切相关。下列说法正确的是
A.用NaOH溶液雕刻工艺玻璃上的纹饰
B.Na202可用于呼吸面具中作为氧气的来源
C.用食醋去除水壶中的水垢时所发生的是水解反应
D.向煤中加入适量CaS04,可大大减少燃烧产物中S02的量。
0.003 mol 0.084 g
加热灼烧后残留的固体含碳酸盐0.003 mol。
(3)一种碱金属的碳酸正盐M′2CO3为0.001 mol,另一种碱金属的酸式碳酸盐MHCO3为0.004 mol
(2M′+60) g·mol-1×0.001 mol+(M+61) g·mol-1×0.004 mol=0.506 g
M′+2M=101
讨论可得:M′=23 M=39
所以为KHCO3和Na2CO3的混合物。
答案:(1)0.004 (2)0.003
(3)KHCO3、Na2CO3(推理过程略)
10.现有一种碱金属的碳酸正盐和另一种碱金属的酸式碳酸盐组成的混合物,取0.506 g加热至质量不再变化,把放出的气体通入足量的澄清石灰水中,得到白色沉淀0.200 g。把加热后残留的固体与足量稀硫酸充分反应,生成的气体充分干燥后通过足量的过氧化钠粉末,结果过氧化钠粉末增重0.084 g。问:
(1)混合物中酸式碳酸盐有________________mol。(不写计算过程)
(2)加热灼烧后残留的固体含碳酸盐_______________mol。(不写计算过程)
(3)通过计算,确定这两种盐的化学式,写出计算和推理过程。
解析:碱金属盐混合物计算是高考的热点。在解此题的过程中必须应用关系式法、差量法这些技巧,并通过相对原子质量计算讨论推理。
(1)2MHCO3 M2CO3+H2O+CO2↑
M2CO3+H2O+CO2↑
CO2+Ca(OH)2====CaCO3↓+H2O
2MHCO3-CaCO3
n(MHCO3)=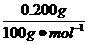 ×2=0.004 mol。
×2=0.004 mol。
(2)2CO2+2Na2O2====2Na2CO3+O2Δm
2 mol 56 g
9.在长期载人太空飞行的宇航器中,每个宇航员平均每天需要消耗0.9 kg氧气,呼出1.0 kg二氧化碳。为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的科学探索。有的科学家提出“金属过氧化物处理系统”,即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。有关反应的化学方程式是①_________________________;②_________________________;将处理后的气体充入座舱时,应注意采取的一项措施是___________________________。有人提出用超氧化钾(KO2)代替过氧化钠供氧,预计其优点是_________________________________。
解析:过氧化钠可与飞船座舱内的CO2和水蒸气反应:2Na2O2+2CO2====2Na2CO3+O2,
2Na2O2+2H2O====4NaOH+O2↑,由于人呼出的CO2的质量远大于水蒸气的质量,故考虑CO2与Na2O2反应生成O2,由方程式计算知,宇航员呼出1.0 kg CO2与Na2O2反应产生的O2为0.36 kg,小于宇航员需要消耗的0.9 kg氧气,故需通过补充水蒸气,既用于补充所需的氧气,又能维持空气成分的稳定。KO2与CO2的反应方程式为:4KO2+2CO2====2K2CO3+3O2,可以计算1.0 kg CO2与KO2反应生成O2的质量为1.1 kg,与Na2O2相比释放的O2多。
答案:2Na2O2+2CO2====2Na2CO3+O2 2Na2O2+2H2O====4NaOH+O2↑ 补充适量的水蒸气 消耗等质量的CO2,KO2释放出的O2比Na2O2更多
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com